Salut,
Ordne Penta-1-ol , Butan-2-ol und 2-Methylbutan-2-ol nach steigender Siedetemperatur.
Kann jemand begründen, welches Alkohol die höchste Siedetemperatur hat?
Penta-1-ol ( primärer Alkohol) und 2-Methylbutan-2-ol (tertiärer Alkohol) sind beides Pentanol - Isomere gleicher molarer Massen der Summenformel C5H11OH:
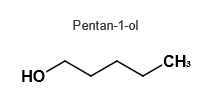
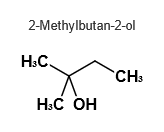
Das Pentan-1-ol - Molekül ist langgestreckt und weist infolgedessen größere Kontaktflächen, größere van - der - Waals - Kräfte und damit eine höhere Siedetemperatur auf als das eher kugelförmige 2-Methylbutan-2-ol - Molekül.
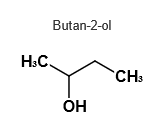
Butan-2-ol schließlich bildet aufgrund seiner im Vergleich geringeren Molekülmasse das Schlusslicht.
°°°°°°°°°°°°°°°°°°
Die Reihenfolge nach steigender Siedetemperatur stellt sich also folgendermaßen dar:
Butan-2-ol < 2-Methylbutan-2-ol < Pentan-1-ol
Ein abschließender Blick ins Tabellenwerk bestätigt dies:
Siedetemperatur Pentan-1-ol: 138°C, 2-Methylbutan-2-ol: 102°C, Butan-2-ol: 99,5°C.
Gruß in Eile ...