Aufgabe:
Kann mir jemand diese Gleichung mir bitte erklären
Problem/Ansatz:
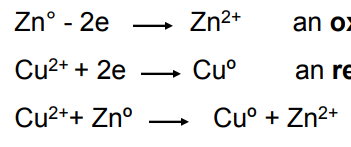
Text erkannt:
\( \mathrm{Zn}^{\circ}-2 \mathrm{e} \rightarrow \mathrm{Zn}^{2+} \quad \) an 0
\( \mathrm{Cu}^{2+}+2 \mathrm{e} \rightarrow \mathrm{Cu}^{\circ} \quad \) an \( \mathrm{re} \)
\( \mathrm{Cu}^{2+}+\mathrm{Zn}^{\circ} \rightarrow \mathrm{Cu}^{\circ}+\mathrm{Zn}^{2+} \)