Grüße chemweazle,
Zur Menschutkin-Reaktion von n-Methylimidazol mit Chlorethan
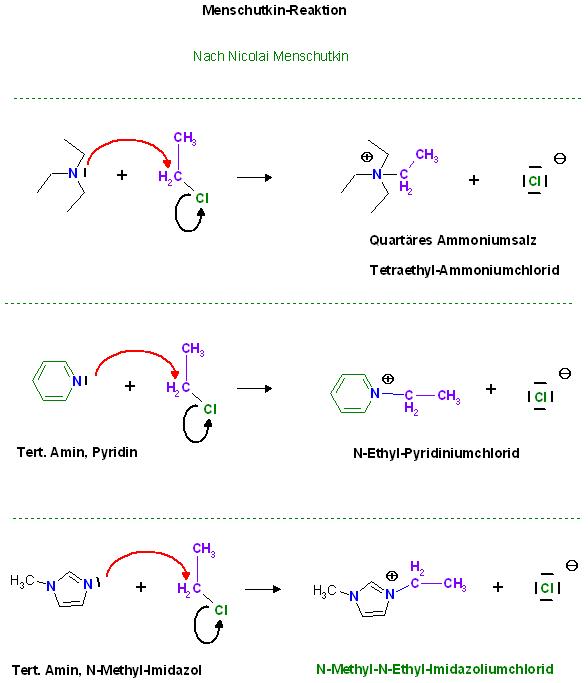
Das N-Methyl-imidazol wirkt hier wie ein gewöhnliches tert. Amin als Nucleophil. Das Produkt ist eine Art von quartären Ammoniumsalz.
Menschutkin-Reaktion
Tertiäre Amine, Phosphane lassen sich am Freien Elektronenpaar am Stickstoff- bzw. Phosphoratom zu den Quartären Ammoniumsalzen bzw. Quartären Phosphoniumsalzen alkylieren.
Ebefalls verhalten sich Stickstoff-Aromaten, wie Pyridin und n-Methyl-Imidazol wie tert. Amine und gehören fast noch in diese Sammlung.
Nicolai Menschutkin, Uni-Marburg 1891
Triethylamin, tert. Amin wird mit Chlorethan zum Quartären N-Tetra-Ethyl-ammniomchlorid alkyliert.
R3N | + Cl–CH2-CH3 → R3N⊕ + Cl⊖
Triphenylphosphan wird mit Benzylbromid zu Quartären Benzyl-Triphenyl-Phosphoniumbromid alkyliert.
Ph3P | + Br–CH2-Ph → Ph3P⊕–CH2-Ph + Br⊖
Menschutkin-Reaktion Weitere Beispiele- Skizze