Hi here chemweazle,
Allgemeiner Reaktionsmechanismus der radikalischen Chlorierung auch Bromierung von Alkanen
Start, Startreaktion oder auch Initierung genannt
Die homolytische Spaltung(Homolyse) oder homolytische Dissoziation der Chlormoleküle, kann einerseits durch Erwärmen erfolgen, sowie auch durch Bestrahlen mit Licht (Blaulicht) erreicht werden.
Beim Erwärmen stoßen die Moleküle heftig aneinander und werden zu Schwingungen angeregt. Erreicht die kinetische Energie der Schwingungen die Dissoziationsenergie, so reißen die Bindungen auseinander, ähnlich wie bei 2 Kugeln, die mit einer Spiralfeder verbunden sind und so heftig schwingen, daß die Feder reißt.
Beim Bestrahlen mit Lichtquanten der passenden Frequenz wird aus den Chlormolekülen jeweils aus dem bindenden Elektronenpaar ein elektron in ein höheres Niveau angehoben, die Bindung lockert sich nun etwas. Dann fällt das angeregte, angehobene Elektron wieder in ein niedrigeres Energieniveau und die freiwerdende Energie bringt das molekül so heftig in Schwingung, daß es in 2 Atome zerreißt.(Homolyse)
Cl-Cl → Cl• + •Cl , bei Erwärmung oder Bestrahlung mit Licht
Kettenfortpflanzung auch Propagation genannt
R-H + •Cl → R• + H-Cl, Teilschritt 1
R• + Cl-Cl → R-Cl + •Cl, Teilschritt 2
_____________________
R-H + •Cl + R• + Cl-X → R• + H-Cl + R-Cl + •Cl
R-H + Cl-Cl → R-Cl + H-Cl
Die Summe der Propagationsteilschritte ergibt, wenn nicht noch ein zusätzlicher Reaktionsschritt beteiligt ist, die Bruttoreaktion.
Rekombinationen der übrig gebliebenen Radikale
Nun, die Halogenatome (Chloratome) können rekombinieren (Atomrekombination, in der Gasphase mit einem Dreierstoß mit einem anderen Molekül, welches die freiwerdende Energie bei der Bindungsbildung aufnimmt).
Cl• + •Cl → Cl-Cl
Rekombination eines Halogenatoms mit einem Alkylradikal
R• + •Cl → R-Cl
Dimerisierung zweier Alkylradikale
R• + •R → R-R
Reaktion von Chlor mit n-Propan
Bei der Reaktion von Chloratomen mit n-Propanmolekülen entstehen 2 Sorten von Radikalen.
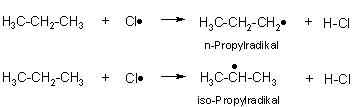
Das Chloratom hat die Möglichkeit, an einer äußeren C-H-Bindung einer Methylgruppe (CH3-Gruppe) oder an einer C-H-Bindung der innen befindlichen Methylengruppe (CH2-Gruppe) anzugreifen.
Es enstehen das n-Propylradikal und das iso-Propylradikal ((CH3)2CH•)
Erwartung
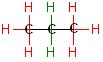
Ein Halogenatom (Chloratom) hat sechs Möglichkeiten pro Molekül Propan an einer äußeren C-H-Bindung (rot) anzugreifen. Dagegen gibt es nur 2 Möglichkeiten für den Angriff an einer der beiden C-H-Bindungen (grün) der Methylengruppe.
Man könnte erwarten, daß ein Stoffmengenverhältnis der Radikale pro Zeit und pro Volumen, n-Propyl zu iso-Propyl von 6 zu 2 ist gleich 3 zu 1 beträgt.
Dadurch müßten auch die beiden Reaktionsprodukte (1-Chlorpropan und 2-Chlorpropan) im gleichen 3:1-Verhältnis entstehen.
CH3-CH2-CH2• + Cl-Cl → CH3-CH2-CH2-Cl + •Cl
(CH3)2CH• + Cl-Cl → (CH3)2CH-Cl + •Cl
Also das Stoffmengenverhältnis von 1-Chlorpropan zu 2-Chlorpropan müßte 3:1 betragen.
Die Realität zeigt ein anderes Produktverhältnis. Es entsteht mehr 2-Chlorpropan als nach den oben angestellten Überlegungen.
Das iso-Propylradikal ist von der elektronischen Gesamtenergie her energieärmer, als das n-Propylradikal. Mit der elektronischen Gesamtenergie ist die Summe der kinetischen Energie und der potentiellen Energie aller Elektronen im Molekül gemeint.
Unter milden Bedingungen entsteht das bevorzugt das energieärmere Radikal, das iso-Propylradikal.
Gruß chemweazle