Hi, hier ist chemweazle wieder, habe es geschafft, weitere Skizzen der Sigma-Komplexe azufertigen.
Zu
Könntest du vielleicht die Grenzformeln des Benzonitrils im Fall einer Zweitsubstitution an der o- und m-Stellung hier verôfentlichen, damit ich verstehen kann, was du mit den positiven Formalladungen bei der m-Stellung meinst und wie der elektronenziehende Effekt der Nitrilgruppe in Anwesenheit eines zweiten Substituenten funktioniert? Das habe ich nämlich nicht verstanden.
In den Zerrbildern, den mesomeren Grenzformeln, des Benzonitrils, tritt in der meta-Position keine positive Formalladung auf. Die beiden meta-Positionen haben die Formalladung Null, also netutral.
Die Formalladung Neutral ist um eine Ladungseinheit negativer, als einfach positiv. Daher greift ein Elektrophil eher an an eine neutrale Position an, als an einer Position mit positiver Formalladung. Das Elektrophil möchte ein Elektronenpaar angreifen, das geht nicht an den Positionen, an denen eine positive Formalladung auftritt.
Beim Elektronenmangelaromaten treten in den mesomeren Grenzformeln die positiven Formalladungen in den ortho- und para-Positionen auf.
siehe Skizze
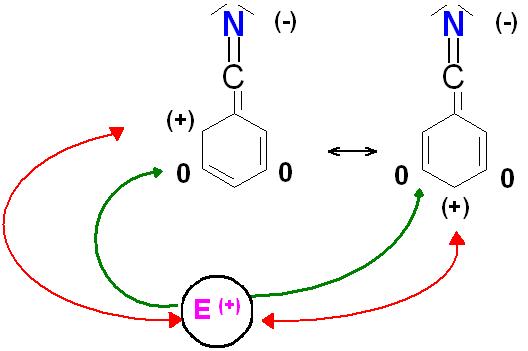
Die roten Doppelpfeile symbolisieren eine elektrostatische Abstoßung zwischen dem (positiv)geladen Elektrophil.
Die grünen Pfeile symbolisieren den elektrophilen Angriff an einer der meta-Positionen, die die Formalladung , (0), d.h. neutral, haben.
Der Elektronenmangelaromat und das Elektrophil addieren sich zu reaktiven, kurzlebigen Zwischenprodukten, den Sigma-Komplexen (s-Komplex) auch Wheland-Komplexe genannt.
Die Elektronenverteilung des Benzonitrils wurde mit drei Grenzformeln dargestellt.
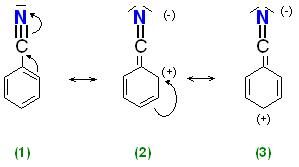
Für den Vergleich läßt man das Elektrophil an die Grenzformeln 2 und 3 in den Positionen ortho, meta und para angreifen.
Besonders hoch ist die Gesamtenergie der Elektronen, wenn gleichnamige Formalladungen, hier in den Beispielen positive Ladungen, an direkt benachbarten Atomen auftreten. Die Gesamtenergie der Elektronen ist dann noch durch die potentielle elektrische Abstoßungsenergie(Coulomb-Abstoßungsenergie) erhöht.
1). Bildung des ortho-Sigma-Komplexes
Skizze

Beim ortho-Angriff an die Grenzformel 2 entsteht auch ein Addukt Nr. 2b mit zwei benachbarten Formalladungen. Auch bei der Addition des Elektrophils an die Grenzformel 3 entsteht ein Addukt Nr. 3a mit zwei benachbarten Formalladungen.
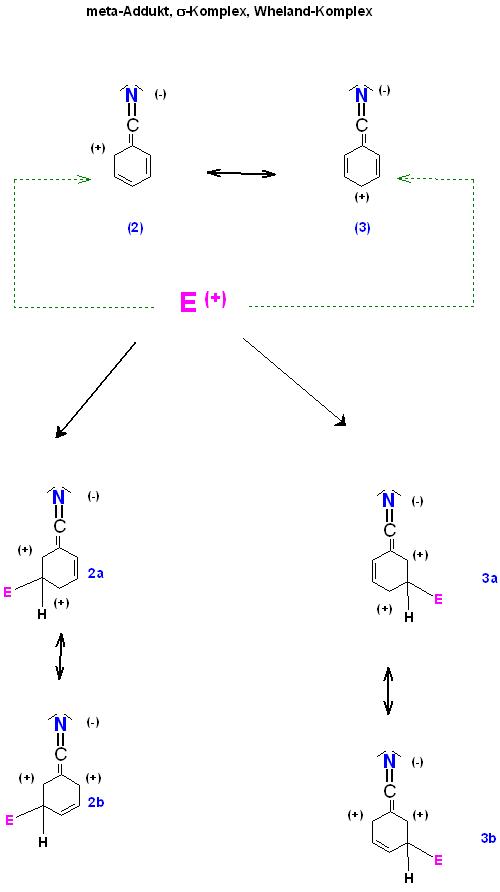
2). Bildung des meta-Sigma-Komplexes
Hier treten zunächst keine Grenzformeln mit zwei benachbarten positiven Formalladungen auf.
Skizze
3).Bildung des para-Sigma-Komplexes
Skizze
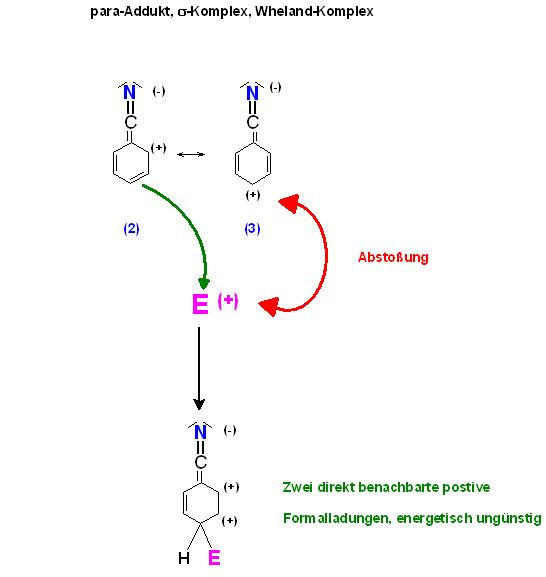
Der Angriff des Elektrophils an die para-Position in Grenzformel Nr. 3 ist durch die Coulomb-Abstoßung nicht möglich.
Ansonsten entsteht das Addukt mit zwei benachbarten positiven Formalladungen beim elektrophilen Angriff in para-Position bei der Grenzformel 2.
Grüße chemweazle