Grüße chemweazle,
Halogen-Addition(Brom-Addition) an Olefine(Alkenen), Vergleich der relativen Reaktionsgeschwindigkeiten, relativen Reaktivitäten zwischen "elektronenreichen Alkenen", mit +I-Substituenten und "elektronenärmeren Alkenen", mit –I-Substituenten
Zu den Aufgaben
b ) der Reaktion von 2,3 - Dimethyl - 2 - buten mit Brom?
Aufgabe: Bei der Reaktion von E-2-Buten mit Brom wurde die Reaktions-geschwindigkeit bestimmt .
Welche Reaktionsgeschwindigkeiten ergeben sich bei a ) der Reaktion von Z - 1,2 - Dichlorethen mit Brom und b ) der Reaktion von 2,3 - Dimethyl - 2 - buten mit Brom ?.
Geben Sie eine begründete Abschätzung der Reaktionsgeschwindigkeit im Vergleich zu der Reaktionsgeschwindigkeit von E-2- Buten mit Brom an.?.
Erklären Sie , wie man die Geschwindigkeit der ablaufenden Reaktionen mit einfachen experimentellen Mitteln bestimmen kann
• Geschwindigkeit-Zeitgesetz
$$\frac{d[Dihalogen-Alkan]}{dt} = - k\cdot [Alken]\cdot [Halogen]$$
• Mechanismus
1. Schritt: Reversible Bildung des sogenannten π-Komplexes
2. Schritt: Reversible Bildung des cyclischen, 3gliedrigen-Rings, des Haloniumions(Bromoniumion), das ist möglicherweise der langsamste Schritt, der geschwindigkeitsbestimmende Schritt
3. Die Nucleophile Addition des Halogenidions, allgemeiner des Gegenions, an das Bromoniumion(Haloniumion) unter Ring-Öffnung, die Bildung des Dihalogen-Alkans
Skizze
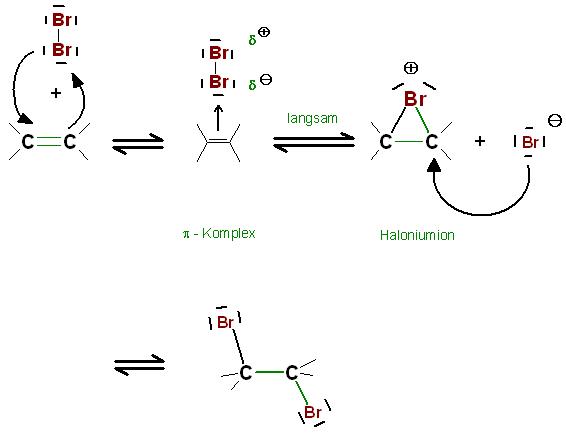
Brom und andere Halogene,Interhalogenverbindungen sowie Hypochlorige Säure, sind Elektronenpaar-Acceptoren. Sie addieren sich elektrophil an das Elektronenpaar einer C-C-Doppelbindung. Das Elektronenpaar des Alkens ist nucleophil.
Oder umgekehrt ausgedrückt, das Alken addiert sich nucleophil an das elektrisch neutrale Elektrophil Halogen.Die Elektronendichte der C-C—Doppelbindung und somit ihre Nucleophilie ist bei mit Elektronen-Donoren, mit +I-Substituenten, substituierten Alkenen größer als beim unsubstituierten Ethen.
Alkylsubstituierte Alkene haben eine höhere Elektronendichte in der C-C-Doppelbindung, als das unsubstituierte Ethen.
Je nucleophiler das Alken ist, desto geringer ist die Aktivierungsenergie für die Bildung des π-Komplexes und des Haloniumions(Bromoniumion). Deshalb ist bei nucleophileren Alkenen mit größerer Elektronendichte die Geschwindigkeitsproportionalitätskonstante größer, als beim unsubstituierten Ethen.
Das hat zur Folge, daß die ersten beiden Teilschritte schneller ablaufen und somit die Reaktionsgeschwindigkeit der Gesamtreaktion größer ist.
Man könnte erwarten, daß die Bildung der Bromoniumionen , der langsamste Teilschritt, bei alkylsubstituierten Alkenen schneller abläuft und somit die Reaktionsgeschwindigkeit größer ist, als beim unsubstituiertem Ethen.
Genauso könnte man erwarten, daß Alkene mit –I-Substituenten, die eine geringere Elektronendichte in der C-C-Doppelbindung aufweisen, schwächer nucleophil sind und bezüglich der Bildung des Bromoniumions langsamer reagieren, als das unsubstituierte Ethen.
Chlorethen müßte demnach langsamer reagieren, als Ethen und die 1,2 Z- und E-Dichlorethenverbindungen noch langsamer.
Eine Haken hat diese Betrachtung:
Halogenatome als Substituenten an der C-C-Doppelbindung verringern einerseits durch den –I-Effekt die Elektronendichte aber durch den +M-Effekt wird die Elektronendichte wieder etwas erhöht.
Halogenatome, OH-Gruppen und Alkoxy-Gruppen, z.B.: CH3-O-, sind –I- und +M- Substituenten.
Oder anders ausgedrückt, sie sind σ-Acceptor- π-Donor-Liganden.
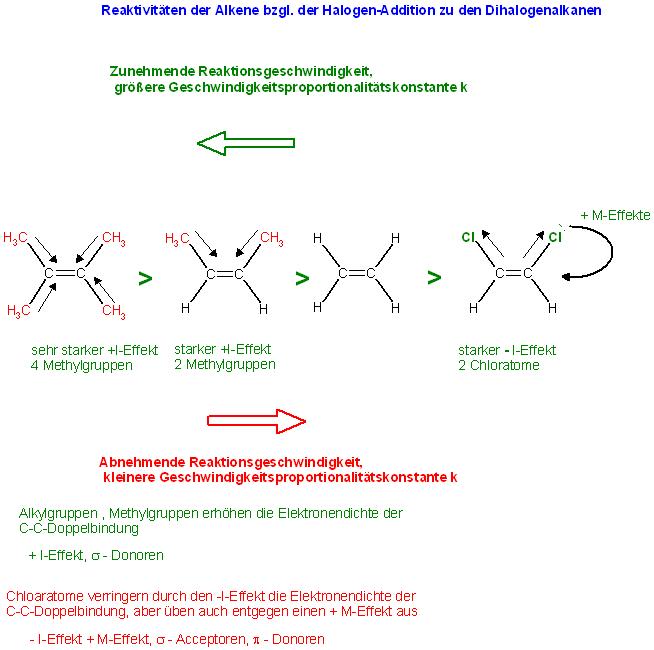
Relative Reaktivitäten bzgl. der Halogen-Addition an die C-C-Doppelbindung zum vicinalen Dihalogen-Alkan
Beim Z-2,3-Dimethyl-2-Buten üben 4 Methylgruppen jeweils einen + I-Effekt aus und erhöhen die Elektronendichte in der C-C-Doppelbindung, beim Z-2-Buten dagegen sind 2 Methylgruppen vorhanden, welche die Elektronendichte in der C-C-Doppelbindung erhöhen.
Beim Propen ist nur 1 Methylgruppe vorhanden. Alle diese Alkyl-Ethene reagieren wohl schneller, als das unsubstituierte Ethen.
⇐ Zunehmende Reaktionsgeschwindigkeiten bei gleichen Konzentrationen, größere Geschwindigkeitsproportionalitätskonstanten(k) ( größere Reaktivitäten)
2,3-Dimethyl-2-Buten, das "Tetramethyl-Ethen" > E-2-Buten > > Ethen > Z- 1,2- Dichlorethen
Abnehmende Reaktionsgeschwindigkeit bei gleichen Konzentrationen, kleinere Geschwindigkeitsproportionalitätskonstanten(k) ( kleinere Reaktivitäten) ⇒
Skizze
• Experimentelle Reaktionsgeschwindigkeits-Bestimmung
Die Konzentrationsabnahme des elementaren Broms während der Reaktion mit der Zeit läßt sich photometrisch verfolgen. Das Brom ist farbig und absorbiert Licht im sichtbaren Wellenlängen-Bereich.
Ebenso könnte man bei laufender Reaktion aus dem Reaktionsgemisch von Zeit zu Zeit Proben entnehmen. Bei jeder entnommenen Probe muß zunächst das noch unverbrauchte Brom mit überschüssiger Menge an Thiosulfat-Lösung reduziert werden, damit es nicht in der entnommenen Probe mit noch vorhandenem Alken weiterreagiert.
Danach könnte der Restgehalt an noch unverbrauchtem Alken IR-spektroskopisch bestimmt werden.
Oder man titriert die überschüssige Menge an Thiosulfat Iodometrisch zurück und ermittelt somit die Menge und Konzentration an unverbrauchten Brom der Reaktionsmischung.