Grüße chemweazle,
Welcher Reaktionstyp ist das
Reversible Umketalisierung
Reaktionsgleichung der Gesamtreaktion
Katalysator: H(+) aus p-Toluensulfonsäure, CH3-C6H4-SO2-O-H
(CH3)2C(O-CH3)2 + 2(HO-CH2-CH2)CH--CH2CH2-OH ⇌ (CH3)2C(O-CH2-CH2)2CH-CH2-CH2-OH + 2 CH3-OH
Reaktionsverlauf mit Betrachtung der Zwischenschritte in nicht wäßriger Lösung
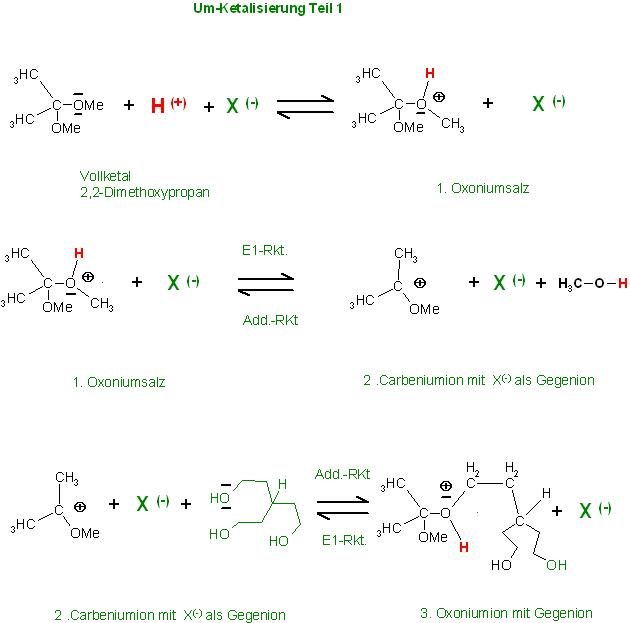
Das Vollketal des Acetons, das 2,2-Dimethoxypropan, wird durch die Säure, hier im Beispiel ist es die p-Toluensulfonsäure an einem der Sauerstoffatome protoniert.
1. Oxoniumsalz
1. Das erste Zwischenprodukt ist ein Oxonium-p-Toluensulfonat.
Die Folgereaktion ist eine E1-Reaktion , es spaltet sich vom protonierten Aceton-Ketal, das Oxoniumion, Alkohol(Methanol) ab. Dabei entsteht ein Carbeniumion. Alle Schritte sind reversibel.
Die Umkehr-Reaktion ist die Addition des Methanols an das C-Atom des Carbeniumions.
2. Produkt : 2. Carbeniumion mit p-Toluensulfonat als Gegenion
Das Carbeniumion reagiert wieder zurück oder addiert als Elektrophil eine OH-Gruppe des 3wertigen Pentantriols unter Bildung des protonierten gemischten Ketal-Kations (eine Sorte Oxoniumion).
3. Produkt : 3. Oxoniumion 3 mit p-Toluensulfonat als Gegenion
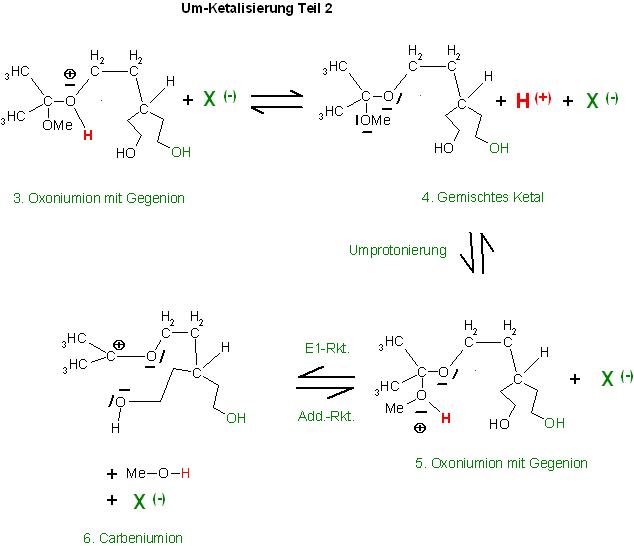
Nach der Deprotonierung entsteht das gemischte Ketal.
4. Produkt : 4. Gemischtes Ketal
Siehe Skizzen Teil 1 und Teil 2 zur Um-Ketalisierung
Das Gemischte Ketal, Produkt 4, kann durch Protonierung an einem der beiden Sauerstoffatome wieder zum Oxoniumion 3 (Umkehrreaktion) oder durch Protonierung am anderen der beiden Sauerstoffatome, das der Methoxygruppe, zum
Oxoniumion 5 weiterreagieren.
5. Oxoniumion mit Gegenion
E1-Reaktion, die reversible Abspaltung von Methanol zum Carbeniumion 6.
6. Carbeniumion mit Gegenion
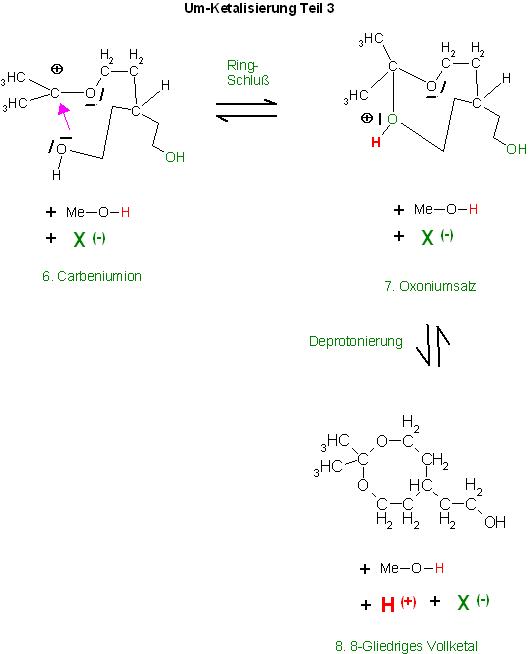
Die Addition einer OH-Gruppe des Seitenrestes am mehrwertigen Alkohol-Rest führt unter Ringschluß zum 8-gliedrigen , cyclischen Oxoniumion, das ist das protonierte 8-gliedrige, cyclische Voll-Ketal des Acetons, gebildet mit dem Triol.
7. Oxoniumion , Oxoniumsalz
Deprotonierung, reversible, führt zum gewünschten 8-gliedrige, cyclische Voll-Ketal des Acetons 8.
8. 8-gliedriges, cycl. Vollketal