Grüße chemweazle,
Zur
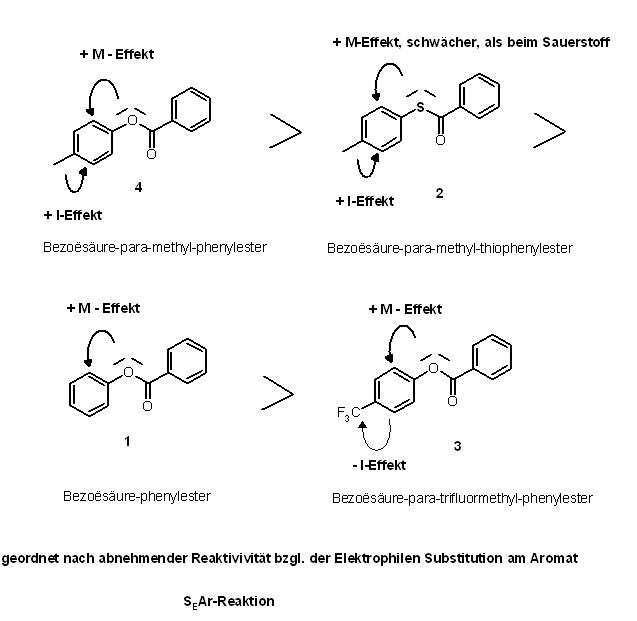
Ordnung der substituierten Aromaten nach abnehmender Reaktivität bezüglich der Elektrophilen Substitution am Aromat, SE-Ar
Hinweis : Der - I - Effekt des Sauerstoffatoms , der ziehende Effekt, wird durch den + M - Effekt überkompensiert, sodaß Sauerstoffatome am Aromat zu den Donorsubstituenten zählen, diese erhöhen stark die Elektronendichte im Aromatischen π-System .
4 ( Benzoësäure-para-methyl-phenylester ) > 2 ( Benzoësäure-para-methyl-thiophenylester ) > 1 ( Benzoësäure-phenylester ) > 3 ( Benzoësäure-para-trifluormethyl-phenylester )
Ich war mir die ganze Zeit mit dem Schwefelatom unsicher, inwiefern dieses einen starken oder schwachen + M-Effekt ausübt.
Nach längerer Überlegung, komme ich zum Schluß, da Schwefel 3p-Elektronen aus den freien Elektronenpaaren zum + M-Effekt bereitstellen kann, dieser schwächer als beim Sauerstoff ausgeprägt ist.
Sauerstoff hingegen hat 2p-Elektronen, diese wechselwirken stärker mit den 2p-Eletronen im Aromat, deshalb übt der Sauerstoff gegenüber dem Schwefel einen stärkeren + M – Effekt aus.
Bildchen