Aufgabe:
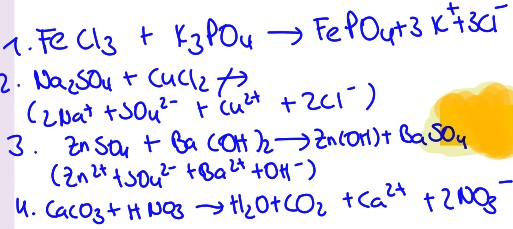
Text erkannt:
\( \begin{array}{l}\text { 1. } \mathrm{FeCl}_{3}+\mathrm{K}_{3} \mathrm{PO}_{4} \rightarrow \mathrm{FePO}_{4}+3 \mathrm{~K}^{+}+3 \mathrm{Cl}^{-} \\ \mathrm{Na}_{2} \mathrm{SO}_{4}+\mathrm{CuCl}_{2}+{ }_{2+} \\ \left(2 \mathrm{Na}^{+}+5 \mathrm{Ou}^{2-}+\mathrm{Cu}^{2 t}+2 \mathrm{Cl}^{-}\right) \\ \text {3. Zn } \mathrm{Za}_{4}+\mathrm{Ba}(\mathrm{CO})_{2} \rightarrow Z_{n}(\mathrm{OH})+\mathrm{BaSO}_{4} \\ \left(\mathrm{Zn}^{2+}+\mathrm{SO}^{2-}+\mathrm{Ba}^{2+}+\mathrm{OH}^{-}\right) \\ \text {4. } \mathrm{CaCO}_{3}+\mathrm{H}_{3} \rightarrow \mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2}+\mathrm{Ca}^{2+}+2 \mathrm{NO}_{3} \\\end{array} \)
Text erkannt:
a. \( \mathrm{FeCl}_{3} \) und \( \mathrm{K}_{3} \mathrm{PO}_{4} \)
b. \( \mathrm{Na}_{2} \mathrm{SO}_{4} \) und \( \mathrm{CuCl}_{2} \)
c. \( \mathrm{ZnSO}_{4} \) und \( \mathrm{Ba}(\mathrm{OH})_{2} \)
d. \( \mathrm{CaCO}_{3} \) und \( \mathrm{HNO}_{3} \)
a. \( \mathrm{Fe}^{3+}+3 \mathrm{Cl}^{-}+3 \mathrm{~K}^{+}+\mathrm{PO}_{4}^{3-} \rightarrow \mathrm{FePO}_{4}(\mathrm{~s})+3 \mathrm{~K}^{+}+3 \mathrm{Cl}^{-} \)
b. \( 2 \mathrm{Na}^{+}+\mathrm{SO}_{4}^{2-}+\mathrm{Cu}^{2+}+2 \mathrm{Cl}^{-}+ \)
c. \( \mathrm{Zn}^{2+}+\mathrm{SO}_{4}^{2-}+\mathrm{Ba}^{2+}+2 \mathrm{OH}^{-} \rightarrow \mathrm{Zn}(\mathrm{OH})_{2}(\mathrm{~s})+\mathrm{BaSO}_{4}(\mathrm{~s}) \)
d. \( \mathrm{CaCO}_{3}(\mathrm{~s})+2 \mathrm{H}^{+}+2 \mathrm{NO}_{3}^{-} \rightarrow \mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2}(\mathrm{~g})+\mathrm{Ca}^{2+}+2 \mathrm{NO}_{3}^{-} \)
Hallo,
ich verstehe nicht ganz, woher man bei solchen Reaktionen weiß, welche Ionen zu einem Festkörper der schwer löslich ist und ausfällt reagieren und welche als Ionen weiterhin hydratisiert vorliegen können.
Gibt es hierfür Regeln oder Gesetzmäßigkeiten??
Danke schonmal im Voraus für eure Antworten :)
Problem/Ansatz: