Salut Lila,
das Methanmolekül besitzt eine tetraedrische Anordnung, wobei die 4 H - Atome bestrebt sind, einen möglichst großen Abstand voneinander einzunehmen. Dein Beispiel ist also richtig, nur deine Zeichnung stimmt leider nicht, denn alle H - Atome müssen eine Bindung zum Zentralatom C aufweisen. Der Bindungswinkel H - C - H beträgt 109,5°.
(Abbildungen des tetraedrischen Methan-Moleküls findest du en masse im Netz.)
Bortrifluorid ist ein gutes Beispiel für ein trigonal - planares Molekül. Die Fluor - Atome formen die Eckpunkte eines Dreiecks, in dessen Mitte sich das Bor - Atom aufhält. Somit stimmt auch hier deine diesbezügliche Zeichnung nicht. Der Bindungswinkel F - B - F beträgt 120°, was einem gleichschenkligen Dreieck entspricht.
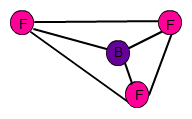
(Graphik selbst erstellt)
Viele Grüße :)