Salut DrOctavius,
Ethanal besitzt das Kohlenstoffgerüst von Ethan, verfügt aber zusätzlich über eine Aldehydgruppe:
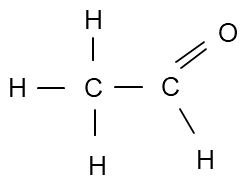
(Quelle: Eigene Grafik)
Ganz wichtig ist hierbei die C = O - Doppelbindung, d.h. zwei gemeinsame Elektronenpaare, die den Zusammenhalt gewährleisten.
Schau dir jetzt die Elektronegativität (EN) von Sauerstoff und Kohlenstoff an:
EN (O) = 3,4, EN (C) = 2,4
Da die EN - Differenz großer ist als 0,5, kommt es zur Entstehung von Partialladungen.
Der Sauerstoff mit seiner höheren Elektronegativität zieht die Elektronen des Kohlenstoffs an sich, wodurch das C- Atom positiv, das O - Atom hingegen negativ polarisiert wird. Im Gegensatz zu zwei Propanmolekülen können zwei Ethanalmoleküle somit nicht einfach aneinander "vorbeirutschen", weil eben elektrische Anziehungskräfte zwischen ihnen herrschen, die die zwischenmolekularen Kräfte merklich verstärken. Beim Propan hingegen sind allein die zwischenmolekularen Kräfte für den Zusammenhalt der Moleküle zuständig.
Dies wäre die Begründung, warum Ethanal höher siedet als Propan.
Viele Grüße :)