Salut,
nein, das ist nicht richtig und wenn überhaupt, dann müsste Silicium als Zentralatom in der Mitte stehen.
Etwas sinnvoller wäre diese deine Darstellung:
https://www.chemielounge.de/3227/silizium-reagiert-mit-sauerstoff
Leider jedoch auch dort nicht richtig, selbst wenn du versucht hast, analog zum CO2 aufzubauen, was dann von der Struktur erstmal stimmig gewesen wäre.
Aber: Silicium ist nicht in der Lage Doppelbindungen auszubilden. Im SiO2 liegen nur 4 Einfachbindungen vor und es ist darüberhinaus polymer. Es kommt zur Bildung eines riesigen Netzwerkes an SiO4 Tetraedern, die sich letztlich den vollständigen Kristall durchziehen. Wie ich dir schon in meiner vorherigen Antwort sagte, gehört dabei jeder Sauerstoff je zur Hälfte zu einem Silicium. Daraus resultiert schlussendlich die Zusammensetzung SiO2.
Damit will ich aussagen, dass man keine geschlossene Lewis-Formel von SiO2 aufmalen kann, höchstens einen kleinen Ausschnitt aus dem sehr großen Molekül.
Schau diesbezüglich mal hier:
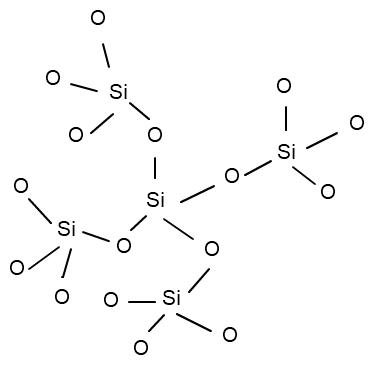
(Quelle: Eigene Grafik)
Viele Grüße :)