Grüße chemweazle,
zur Frage
Warum ist es zwischen den beiden Doppelbindungen eine sp-Hybridisierung?
Aufgabe: Bindungen angeben bei Skelettformel
siehe Grafik
Warum ist es zwischen den Doppelbindungen eine sp-Hybridisierung? Ich dachte, dass es nur bei Dreifachbindungen (wie Ethin) eine sp-Hybridisierung gibt?
Sind die anderen korrekt eingezeichnet? Ja, die sind korrekt markiert.
Skizze
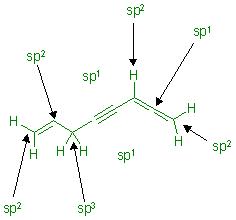
Nochmals die Skizze mit dem Molekülzeichenprogramm nachskizziert
Die ausgezeichneten Hybridisierungen an den jeweiligen C-Atomen stimmen. Das hast Du korrekt gemacht, gut.
Es stimmt auch, daß das mittlere C-Atom des Cumulen-Gerüsts sp1-hybridisiert ist.
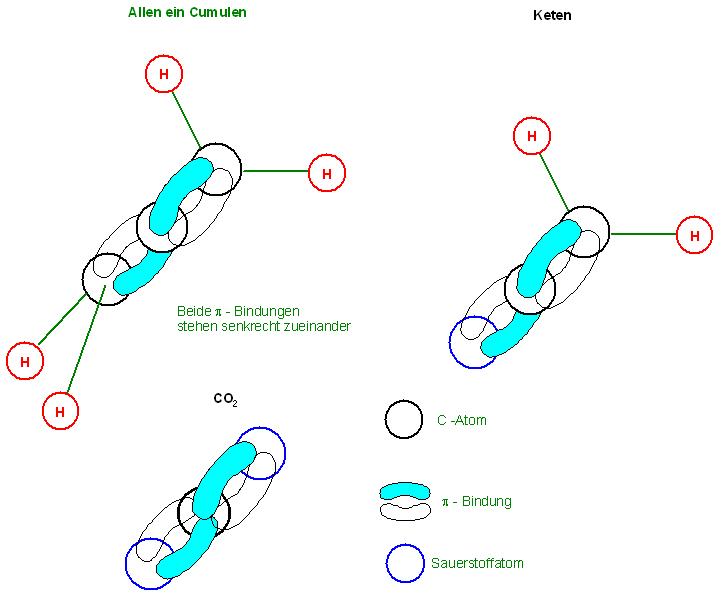
Bei Allenen, bzw. Allen-derivaten, auch mit dem Sammelwort Cumulene bezeichnet, liegen zwischen 3 C-Atomen 2 Doppelbindungen vor.
Beispiele hierfür sind u.a.:
Allen : CH2=C=CH2
CO2 : O=C=O oder Kohlenstoffdisulfid(Schwefelkohlenstoff)S=C=S
Keten : CH2=C=O
Das mittlere Atom, meist ein C-Atom, wie in diesen Beispielen, es ist das 2te C-Atom von den 3 C-Atomen, ist sp1-hybridisiert. Die beiden äußeren Atome sind sp2-hybridisiert.
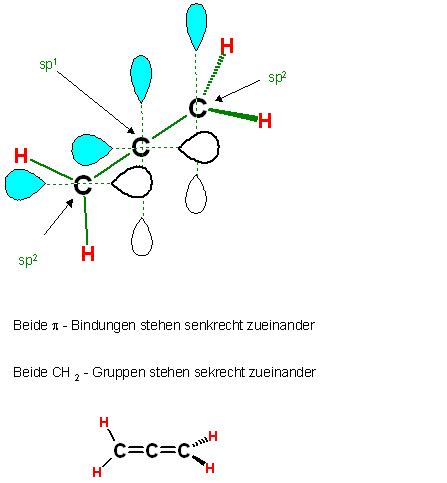
Das mittlere c-Atom ist sp1 hybridisiert, es liefert 2 sp1-Hybrid-Orbitale für 2 σ-Bindungen und 2 senkrecht zueinander stehende 2p-Atomorbitale, ein jedes für eine π-Bindung.
Die beiden Doppelbindungen, π-Bindungen stehen senkrecht zueinander.
Skizze
Text erkannt:
Beide \( \pi \) - Bindungen stehen senkrecht zueinander
Beide \( \mathrm{CH}_{2} \) - Gruppen stehen sekrecht zueinander
Denkt man sich beim Allen eine CH2-Gruppe durch ein sp2-hybridisiertes Sauerstoffatom ersetzt, so gelangt man zum Keten,CH2=O, beim gedanklichen Ersatz beider CH2-Gruppen durch Sauerstoffatome zum Kohlendioxid, O=C=O.
Skizze