Grüße chemweazle,
hab heute Nacht schon dran gearbeitet, bin aber eingeschlafen.
Zur Kleinen Ergänzung
Wie sieht diese Verbindung bei diesen pH-Werten aus?
N-Amino-Acetyl-N-Methyl-piperazin
Der Piperazin-Ring ist der Sechsring mit den 2 Stickstoffatomen in 1,4-Stellung im Ringgerüst.
Funktionelle Gruppen : Carbonsäure-amid, diese hat einen nicht basischen Stickstoff
prim. Amin und ein tert. Amin
Skizze 1
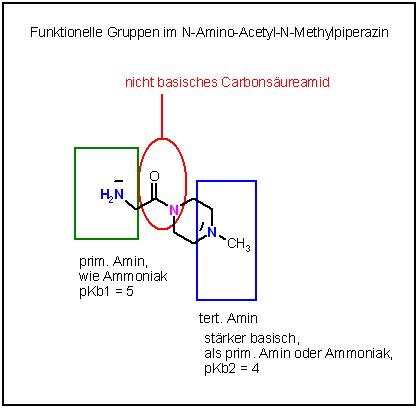
Tert. Amine sind stärker basisch, als die prim. Amine und Ammoniak.
Carbonsäureamide hingegen reagieren in Wasser nicht alkalisch, sie machen keine Basenreaktion, und lassen sich mit starken Säuren nicht am Stickstoffatom protonieren.
Skizze 2
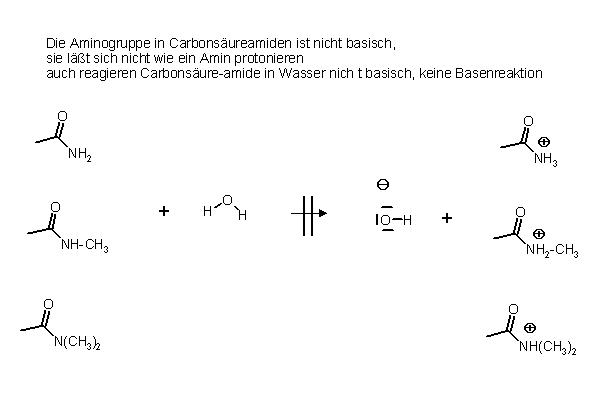
Die pKs-Werte von den schwach sauren Ammoniumsalzen prim. Amine betragen ca. 9. Die Kationen, die Ammoniumionen, sind die konjugierten Säuren zu den schwach basischen prim. Aminen, deren pKb-Werte, bei der Temperatur von 25 °C ca. um den Wert von 5 liegen.
pKb = 14 – pKs = 14 – 9 = 5
Bei den stärker basischen tert. Aminen liegt der pKb-Wert so um die 4 und der pKs-Wert der Ammoniumionen in den schwach sauren Ammoniumsalzen ca. bei 10.
Die verschiedenen konjugierten Basen und Säuren
Man kann dieses doppelte Amin an beiden Stickstoffatomen protonieren, indem man diese Substanz z.B. in konz. Salzsäure löst und anschließend den Chlorwaserstoff und das Wasser-Chlorwasserstoff-Azeotrop mittels Vakkumdestillation entfernt. Es bleibt ein Feststoff übrig. Die beiden positiv geladenen Ammoniumgruppen sind durch jeweils 2 Chloridionen von der Ladung her abgedeckt.
Ich gebe der doppelt protonierten Form , die eine 2basige, 2wertige schwache Säure ist, den Namen doppelt saures Ammoniumalz.
Im stark alkalischen Millieu liegt überwiegend bis fast ausschließlich die doppelt deprotonierte Form vor. Ich gebe der doppelt deprotonierten Form mal den Spitznamen konjugierte Base 2.
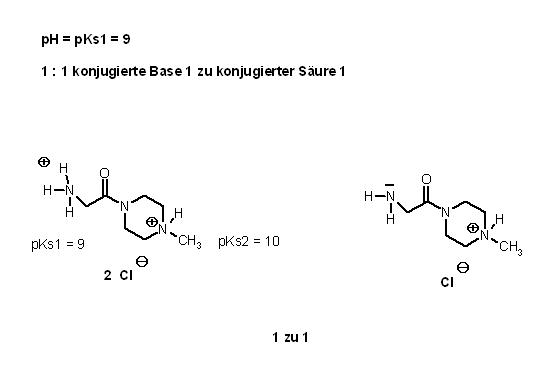
Ein Gedankenschritt: Wie sieht das Verhältnis von konjugierter Base 1 und doppelt saurem Anmmoniumsalz beim pH = pKs1 = 9 Puffer aus?
Hier müssen die konjugierte Base 1 und das doppelt saure Ammoniumsalz im Stoffmengen-Verhältnis 1 : 1 vorliegen.
pH = pKs1 + log_{10}\left[\dfrac{konjugierte Base 1}{doppeltes Ammoniumsalz}\right]
$$9 = 9 + log_{10}\left[\dfrac{1}{1}\right] = 9 + 0$$
Skizze 3
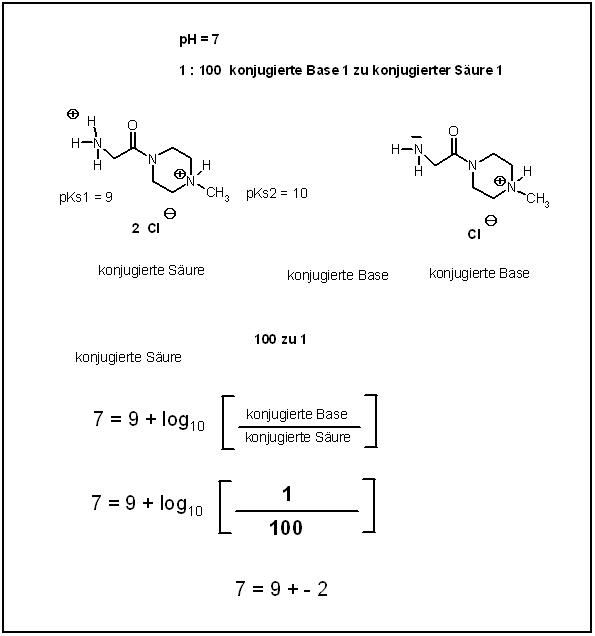
Beim pH-Wert von 7 , Neutralpunkt
Hier muß das Verhältnis von konjugierter Base 1 zu doppelt saurem Ammoniumsalz
1 : 100 betragen.
$$pH = 7 = 9 + log_{10}\left[\dfrac{konjugierte Base 1}{doppeltes Ammoniumsalz}\right]$$
$$pH = 7 = 9 + log_{10}\left[\dfrac{1}{100}\right]$$
$$pH = 7 = 9 + log_{10}(10^{-2})$$
pH = 7 = 9 - 2
Skizze 4
Beim pH-Wert von pH = pKs2 = 10 müssen die doppelt deprotonierte Form die konjugierte Base 2 und die einfach deprotonierte Form, konjugierte Base 1 im Verhältnis 1 : 1 vorliegen.
pH = pKs2 = 10
$$pH = 10 + log_{10}\left[\dfrac{konjugierte Base 2}{konjugierte Base 2}\right]$$
$$pH = 10 + log_{10}[1] = 10 + 0$$
Skizze 5

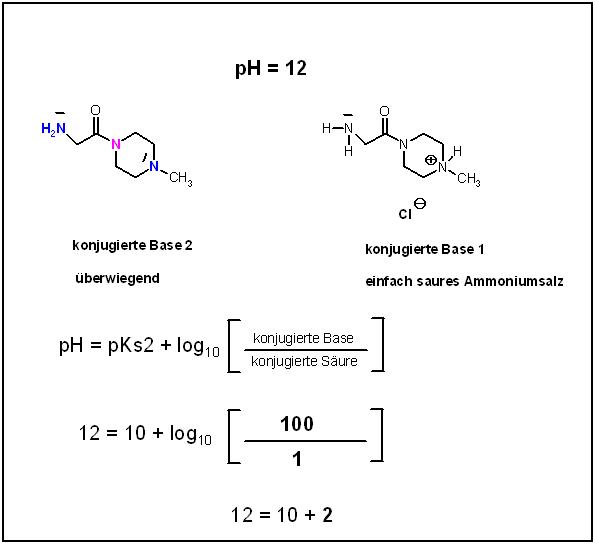
Beim pH- Wert von 12 in der stark alkalischen Lösung überwiegt die konjugierte Base 2, das ist die doppelt deprotonierte Form.
Sie muß im Verhältnis 100 : 1 neben der konjugierten Base 1 , die zu ihr konjugierten Säure vorliegen.
$$pH = 12 = 10 + log_{10}\left[\dfrac{konjugierte Base 2}{konjugierte Base 2}\right]$$
$$12 = 10 + log_{10}\left[\dfrac{100}{1}\right]$$
12 = 10 + 2
Skizze 6