Salut,
Stickstoff steht in der 2. Periode und geht 4 kovalente Bindungen ein.
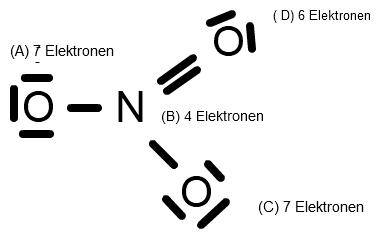
(Quelle: Eigene Grafik)
Dies bedeutet selbstverständlich, dass eine Doppelbindung vorhanden sein muss. Zwei der dortigen Elektronen, die ein Elektronenpaar bilden, stammen vom Stickstoff. Dadurch ist zwar die Oktettregel für den Stickstoff erfüllt, nicht aber dessen natürliche Anzahl an Valenzelektronen. Vorhanden sind summa summarum lediglich 4 Valenzelektronen. Da aber im elementaren Zustand Stickstoff 5 Valenzelektronen besitzt, entsteht am N eine positive Formalladung (+1). Der Sauerstoff bei (A) verfügt über 7 Elektronen, ein Elektron mehr als im elementaren Sauerstoff. Somit kommt es hier zu einer negativen Formalladung (-1). Gleiches gilt für den Sauerstoff bei (C) = (-1).
Dadurch ergibt sich nun: +1 + (-1) + (-1) = -1
Das bedeutet, das Nitrat - Anion hat eine einfach negative Ladung, also NO3 - .
Viele Grüße :)