Super gemacht die Erklärung von cosi_fan_tutte
Hi, here`s chemweazle
Es sollen Sulfidionen ( (S(2-)) im alkalischen Millieu mit Permanganat (MnO4(-)) oxidiert werden. Das Permanganat wird im alkalischen bis im schwach saurem Millieu (pH=4) zum Braunstein reduziert. In stark saurer Lösung wird es zum Mangan(II) (Mn(2+))reduziert. Das Sulfidion könnte in alkal. Lösung sogar bis zum Sulfation (SO4(2-)) oxidiert werden. Auch läßt sich das Sulfit (SO3(2-)) in alkal. Lsg. durch Permanganat zum Sulfat oxidieren. Denke, daß bei passendem stöchiometrischen Verhältnis, die Oxidation von Sulfidionen zum elementaren Schwefel möglich ist.
Teilgleichung f. d. Reduktion des Oxidationsmittels
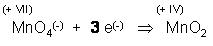
Nun müssen die Elementbilanzen ausgeglichen werden.
Links ein Mangan, rechte Seite ein Mangan
Schritt 1, Ausgleich der Ladungen
Links sind 4 negative Elementarladungen, die 3 e(-) und eine vom MnO(-), rechts fehlen vier, dann nehmen wir rechts 4 OH(-)-Ionen dazu.
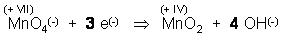
So, nun haben wir die Ladungsbilanz ausgeglichen,
Nun werfen wir einen Blick auf die Sauerstoffbilanz, die stimmt noch nicht.
Links sind nur 4 Sauerstöffer, rechts sind 6 Sauerstöffer.
Na dann nehmen wir für rechts, um die Ladungsbilanz nicht zu verändern, 2 neutrale H2O dazu.
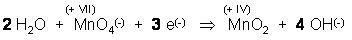
Jetzt stimmt die Sauerstoffbilanz 6 O links und 6 O rechts.
Nun überprüfen wir die Wasserstoffbilanz. Links 2 H2O sind 4 Wasserstöffer,
rechts 4 OH(-) –Ionen sind auch 4 Wasserstöffer.
Teilgleichung f. d. Oxidation des Reduktionsmittels
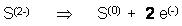
Das Red.-Mittel Red.-Mittel gibt 2 Elektronen ab, das Ox.-Mittel nimmt 3 Elektronen auf. Also bilden wir das gemeinsame Vielfache 2mal 3 e(-) = 3mal 2 e(-)
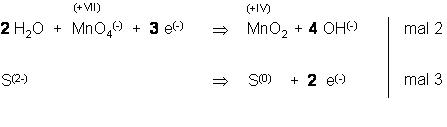
Summengleichung
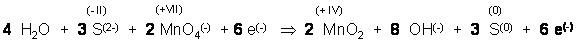
Elementbilanzkontrolle:
- Zwei Mangan links, 2 Mangan rechts
- 3 Schwefel links, 3 Schwefel rechts
- 12 O li., 12 O re.
- 8 H li., 8 H re.