Hi, hier chemweazle,
Zu
Welcher Stoff entsteht neben Glycerin als zweites Hauptprodukt bei der Hydrolyse von Sonnenblumenöl?
Aufgabe:
Welcher Stoff entsteht neben Glycerin als zweites Hauptprodukt bei der Hydrolyse von Sonnenblumenöl? Gibt man Brom hinzu, verschwindet die Farbe des Broms in wenigen Sekunden...
Die Hydrolyse von Fetten ist ja die Verseifungsreaktion, also die Umkehrreaktion der Versterung.
Was sind Fette?
Fette sind Ester, die man sich durch Veresterung aus Glycerin, einem dreiwertigen Alkohol, 1,2,3-Propantriol und langkettigen Carbonsäuren entstanden denken kann.
Bei der Verseifung von Sonnenblumenöl entsteht als Alkohol Glycerin und ein Carbonsäuregemisch, das sind die Fettsäuren.
Langkettige Carbonsäuren, die Fettsäuren im Sonnenblumenöl
Ungesättigte Fettsäuren
Ölsäure(cis- Oktadec-9-en-säure); das ist die einfach ungesättigte Fettsäure
Linolsäure, als zweifach ungesättigte Fettsäure(cis-,cis- Oktadeca-9, 12-diensäure)
Skizze
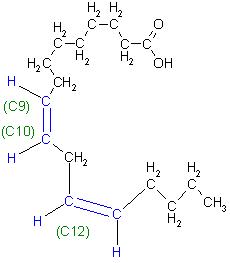
gesättigte Fettsäuren
Stearinsäure(Oktadecansäure) C17H35COOH
Palmitinsäure(Hexadecansäure) C15H31COOH
a). Säurekatalysierte Verseifung
Fett(Ester) plus Wasser ergibt Glycerin plus Fettsäuregemisch, mit starker Mineralsäure als Katalysator.
Die entstehenden Fettsäuren schwimmen über der wässrigen Lösung der Reaktionsmischung. Denn diese lösen sich wegen dem langkettigen Rest kaum in Wasser.
b). Enzymkatalysierte Verseifung mit z.B. Steapsin als Enzym bei der biochemischen Fettverdauung.
Fett plus Wasser bildet Glycerin plus Fettsäuregemisch mit dem Enzym Steapsin als Katalysator.
Skizze
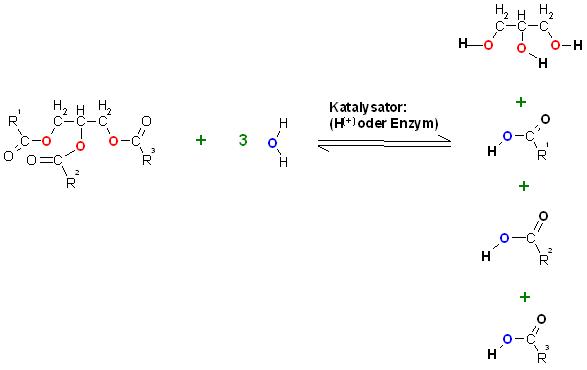
c).Alkalische Verseifung von Fetten(Glycerinester)
Die Verseifung von Fetten kann meist basisch katalysiert erfolgen, es wird hierbei das Natriumhydroxid oder Kaliumhydroxid stöchiometrisch eingesetzt. Hier entstehen die Natrium- bzw. Kaliumsalze der Fettsäuren.
Durch den Einsatz der Alkalihydroxide in stöchiometrischer Menge wird die Verseifung irreversibel, die Umkehrreaktion, die Veresterung wird durch die Enrzeugung der Carboxylationen unmöglich gemacht.
Skizze
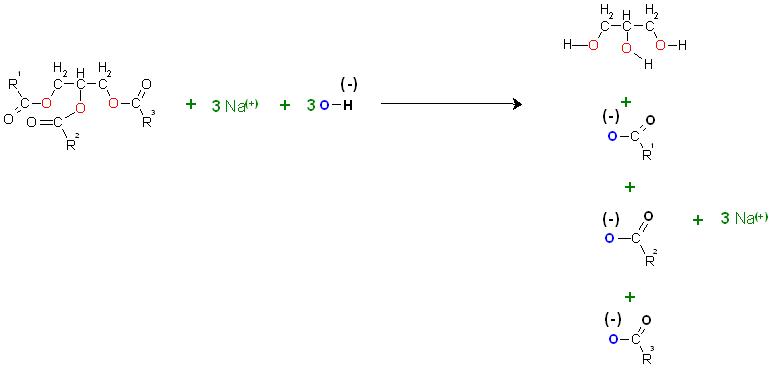
Zur Entfärbung der Bromlösung
Die Entfärbung von Brom zeigt die Anwesenheit von Verbindungen mit C-C-Doppelbindungen oder mit C-C-Dreifachbindungen an.
Hier zeigt die Entfärbung der Brommoleküle die Anwesenheit von ungesättigten Fettsäuren oder deren Alkalisalze im Gemisch an.
Beispiel
Die einfach ungesättigte Ölsäure, cis-Octadec-9-ensäure, addiert an die Doppelbindung ein Molekül Brom zur farblosen Dibrom-Ölsäure.
Skizze
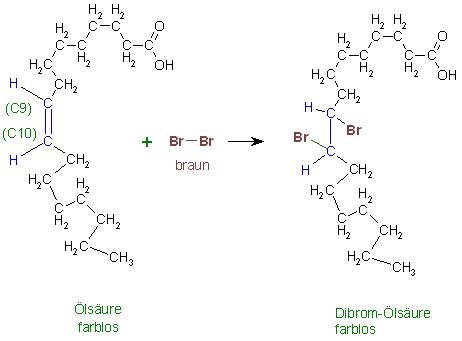
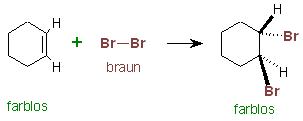
Die braune Farbe der Brommoleküle verschwindet, wenn sich diese an die Doppelbindungen von Alkenen addieren. Die entstandenen Dibromalkane sind farblos.
Tropft man eine Lösung von Brom gelöst in Eisessig zu einem flüssigen Alken z.B. Cyclohexen oder Styrol zu, so verschwindet die braune Farbe der Brommoleküle und es entsteht sogar eine deutliche Wärmetönung.
Skizze
Aufgaben davor:
1. Reaktion Buttersäure + Magnesium
H3C-Ch2-Ch2-COOH +Mg -> H3C-Ch2-Ch2-COO + Mg2+ + H2 (mit einem Pfeil nach oben, wieso der Pfeil?) Ist das eine Gleichgewichtsreaktion, wenn ja wieso?
Die Schreibweise H2↑ dsymbolisiert ein Gas, welches aus der Lösung der Reaktionsmischung entweichen kann. Alternativ gibt es auch die Schreibweise mit dem tiefgestellten eingeklammerten (g), gasförmig, engl. gaseous, H2(g)
Die Reaktion ist irreversibel, sie ist keine Gleichgewichtsreaktion. Die Hydratisierten Magnesiumionen lassen sich nicht in wässriger Lösung zum Metall mittels Wasserstoff reduzieren. Also es gibt keine Gleichgewichtseinstellung, da die Umkehrreaktion, Gegenreaktion, nicht abläuft.
Magnesiumionen lassen sich nicht einmal an der Kathode bei einer Elektrolyse in wässriger Lösung abscheiden, es ist zu unedel. Magnesium wird deshalb durch Schmelzelektrolyse, wie auch das Aluminium hergestellt. Oder alternativ kommt die Reduktion des Manesiumoxides mit Calciumcarbid im kleineren Maßstab zur Anwendung.
Reaktionstyp: Redoxreaktion
Reduktionsmittel Mg0, Oxidationsmittel H(+) aus der Butansäure(Buttersäure)
2 C3H7COOH ⇔ 2 H(+) + 2 C3H7COO(-)
Mg0 + 2 H(+) → Mg(2+) + H2(g)
Die letzte, zweite Teilreaktion ist die nicht umkehrbare Oxidation von Magnesiummetall mittels H(+)-Ionen.
2. leicht verdunstete Flüssigkeit, Siedetemperatur 22°C, positive Silberspiegelprobe, Entstehung Essigsäure
H3C-COO + 2OH- + 2Ag+ → H3C-COOH + 2Ag + 2H2O, Gleichgewichtsreaktion, wenn ja wieso?
Gemeint ist hier wohl der Acetaldehyd in monomerer Form und die Probe nach Tollens mit Silberdiammin-Nitrat([Ag(NH3)2](+)*NO3(-) als Oxidationsmittel zum Hinweis auf Aldehyde.
Die Redoxreaktion läuft wohl wegen dem Silber-diammin-Komplex in leicht ammoniakalischer, alkalischer Lösung, ab.
Reduktions des Oxidationsmittels
[Ag(NH3)2](+) + 2 e(-) → 2 Ag0 + 2 NH3
Oxidation des Reduktionsmittels
CH3-C(I)H=O + 3 OH(-) → CH3-C(III)O2(-) + 2 e(-) + 2 H2O
Das elementare Silber, das Produkt der Reaktion wird nicht in der Lage sein, die Carboxylgruppe von Acetationen bzw. auch von Essigsäure zu reduzieren.
Diese Redoxreaktion ist irreversibel, keine Gleichgewichtsreaktion.
3. Stoff riecht nach Banane, als Duftstoff verwendet; flüchtig und in Wasser nicht löslich (hydrophob); entsteht bei einer Kondensationsreaktion aus Propanol und einer stechend riechenden Säure, die
man zum Würzen von Salat nimmt.
Essigsäure +Propanol -> Essigsäurepropylester + Wasser
Und aus der Erfahrung weiß man, daß
Essigsäurepropylester + Wasser ⇔ Essigsäure + Propanol, wenn eine kleine Menge an starker Säure als Katalysator im Gemisch zugegen ist.
Gleichgewichtsreaktion, wenn ja wieso?
Alle Teilschritte der säurekatalysierten Veresterung sind reversibel, somit ist auch die Gesamtreaktion reversibel, siehe Reaktionsmechanismus.
Noch bananiger riechen der Essigsäure-n-pentylester(Amylacetat) und der Essigsäure-2-Methyl-butylester.