Hi, hier chemweazle,
Radikale Chlorieung mit Sulfurychlrorid
Aufgabe: formulieren sie den Mechanismus der
Chlorierung des nachfolgend abgebildeten Alkens mit Sulfurylchlorid und katalytischen Mengen Dibenzoylperoxid in Tetrachlorkohlenstoff
Wie läuft die Reaktion genau ab, wenn Sulfurychlorid als Chlorquelle benutzt wird, und man mit Dibenzoylperoxid startet?
Es wird ein Allylradikal als Kettenträger R gebildet.
Stichwort: Halogenierung in Allylposition, Radikalische Halogenierung von Allylverbindungen
Skizze
zu Produkt A
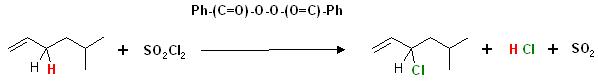
Skizze zum Allylradikal R, der Kettenträger
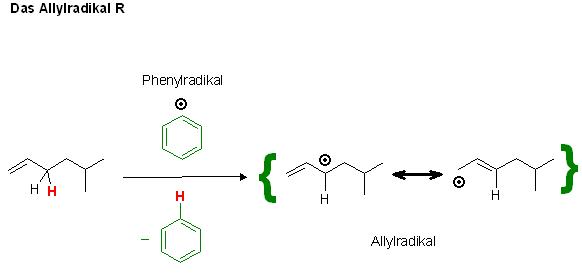
Skizze zur Reaktion des gebildeten Allylradikal R im 1ten Propagationsschritt
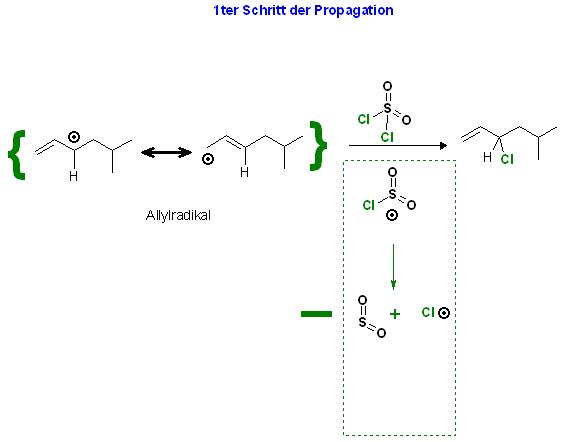
Chlorierung durch radikalische Substitutution durch Einsatz von flüssigem Sulfurylchlorid, das Chlorid der Schwefelsäure, anstelle von gasförmigen Chlor aus der Gasflasche.
Diese Reaktion benötigt einen Radikalstarter z. B. das Dibenzoylperoxid.
Die Initiierung, die Startreaktion bzw. -Reaktionen
Beim Start mit Dibenzoylchlorid entstehen 2 Produkte, es sind 2 Sorten Radikale, die durch die Homolyse der Peroxogruppe enstehen.
Beide Sorten von Radikalen, das Benzoylradikal und das durch CO2-Defragmentierung entstehende Phenylradikal, es ist vermutlich ein Sigma-Radikal, mit ungepaartem Elektron im sp2-Orbital abstrahieren ein H-Atom. Es ist das Radikal R gebildet.
Skizze zum σ-Phenylradikal
Dabei enstehen einmal Benzoësäure und Benzen (Ph-H) (C6H6)
Ph-(C=O)-O-O-(O=C)-Ph → 2 Ph-(C=O)-O ·
Decarboxylierung der Carboxylradikale(CO2-Defragmentierung)
2 Ph-(C=O)-O · → 2 Ph · + 2 CO2
Bildung des Kettenträgers R, das Allylradikal
R—H + · Ph → R · + H—Ph, (C6H6)
R—H + · O-(O=C)-Ph → R · + H-O-(O=C)-Ph
Propagation, Kettenwachstumsreaktion, Kettenfortpflanzungsreaktion
R · + Cl—(SO2)—Cl → R—Cl + · (SO2)—Cl
· (SO2)—Cl → SO2 + Cl ·, Zerfallsreaktion
Cl · + H—R → H-Cl + R ·
Die Propagation unterscheidet sich im Vergleich zur Radikalischen Substitution mit Chlorgas durch einen zusätzlichen Zerfallsreaktionsschritt.
Es ist der Zerfall der Chlorsulfuryl-Radikale in Chloratome und Schwefeldioxid.
Die Kettenträger sind das Radikal R, und das Chloratom. Das Chlorsulfuryl-Radikal ist kein Kettenträger. Es liefert aber durch die Zerfallsreaktion den Kettenträger Chloratom.
___________________________________________________________________________
| R · | + | Cl—(SO2)—Cl | → | R—Cl | + | · (SO2)—Cl |
| · (SO2)—Cl | | | → | SO2 | + | Cl · |
| Cl · | + | H—R | → | H-Cl | + | R · |
Die Summe der Teilgleichungen der Propagtionsschritte inklusive der Zerfallsreaktion des Chlor-sulfuryl-Radikals ergibt die Brutto-Reaktionsgleichung.
| Cl-(SO2)-Cl | + | H—R | → | R-Cl | + | H-Cl | + | SO2 |