Vom Duplikat:
Titel: Siedetemperatur Wechselwirkungen Methanal H2CO, Methanol H3COH, Methan CH4, Natriummethanollat NaH3CO
Stichworte: schmelztemperatur,siedetemperatur,methanal,methan,strukturformel
Hallo liebe Leute,
ich brauche Hilfe bei dieser Aufgabe.
Ich habe mir erstmal alle Strukturformeln aufgeschrieben und dann geguckt, welche Wechselwirkung dort vorliegt. Leider scheiter ich kläglich.

Text erkannt:
(a) Ordnen Sie die folgenden Stoffe in der absteigenden Reihenfolge ihrer Schmelztemperaturen:
\( \bullet \) Methanal \( \left(H_{2} C O\right) \)
\( \bullet \) Methanol \( \left(H_{3} C O H\right) \)
\( \bullet \) Methan \( \left(C H_{4}\right) \)
- Natriummethanolat \( \left(N a H_{3} C O\right) \)
(b) Geben Sie bei jedem der 4 Stoffe die jeweils dominierenden zwischenmolekularen Wechselwirkun-
gen an.
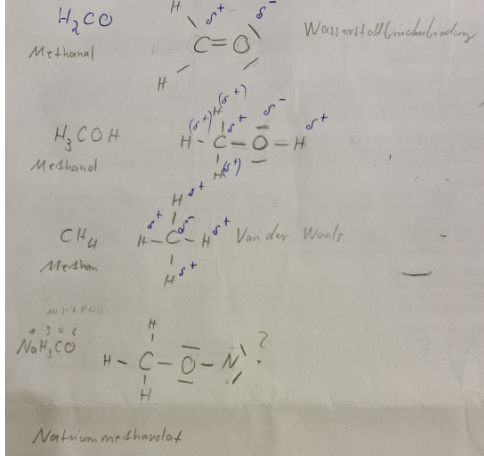
Text erkannt:
\( M_{t}+1 \)
For
Nathiom me thanolat
Methanal Wasserstoffbrückenbindung
Methanol permanenter dipol ??
Ich bin mir hier auch nicht bei der Einzeichnung der Partialladung sicher. C ist Delta Plus gegenüber O
Aber C ist gegen H Delta minus , aber wie Zeichne ich diese nun ein ?
Methan Van der Waals
Natriummethanolat ??? Hier bin ich mir bei der Strukturformel nicht sicher