Salut Alonso,
Ethanol, ein Alkanol mit der Formel C2H5OH lässt sich ableiten von dem Alkan Ethan, C2H6, wobei hier ein H-Atom durch eine funktionelle Hydroxygruppe, also eine OH-Gruppe ersetzt wurde.
Zum besseren Verständnis:
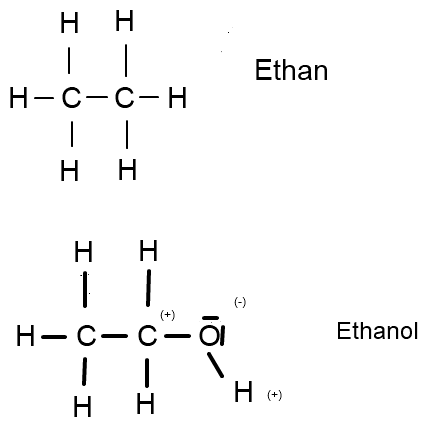 (Quelle: Eigene Grafik)
(Quelle: Eigene Grafik)
(Aufgrund der hiesigen Zeichentools bitte vor die Partialladungen bei Ethanol jeweils ein δ (delta) hinzufügen und Klammern weglassen.)
Der Aufbau der homologen Reihen der Alkane und Alkanole ist dir bekannt ? Bei diesbezüglichen Unklarheiten bitte eine neue Frage posten, um nicht den Rahmen einer einzigen Antwort zu sprengen.
Warum ist die Siedetemperatur von Ethanol z.B. höher als die von Ethan, hat das was mit der Bindungsart zu tun?
Ethan ist ein kurzkettiges, unpolares Molekül. Die Unterschiede in der Elektronegativität EN von Kohlenstoff und Wasserstoff sind zu unwesentlich, um eine Ladungsverschiebung zu erzielen. (EN (C) = 2,5, EN (H) = 2,2, woraus sich eine EN-Differenz von lediglich 0,3 ergibt.) Die einzelnen Moleküle werden also lediglich durch sehr schwache van-der-Waals-Kräfte zusammengehalten. Dies allein erklärt bereits die niedrige Siedetemperatur von -89°C.
Ein Alkohol wie Ethanol hingegen besitzt eine stark polare Hydroxy-Gruppe (OH-Gruppe), welche es möglich macht, dass die Alkoholmoleküle untereinander Wasserstoffbrücken ausbilden können. Die Elektronegativität EN von Sauerstoff beträgt 3,44. Das ergibt zum Kohlenstoff eine Differenz von bereits 0,94. Gleichzeitig zeigt sich aber nicht nur eine Ladungsverschiebung hinsichtlich des C-Atoms, sondern auch in Bezug auf das gebundene H-Atom. Es entsteht dadurch am Sauerstoff-Atom eine negative Partialladung, an dem mit ihm verbundenen Wasserstoff- bzw. Kohlenstoffatom eine positive Partialladung.
Je stärker also die Polarität, umso mehr ziehen sich die positiven und negativen Enden der Moleküle gegenseitig an und umso höher liegt der Siedepunkt. Bei Ethanol wären das +78,3°C.
Warum heißen die dann später eig. z.B. n-Buten, n, Pentan...
Was meinst du mit später
Buten ist übrigens ein Alken. Alkene besitzen im Vergleich zu Alkanen eine oder mehrere Doppelbindungen zwischen zwei C-Atomen.
Ich denke aber eher, dass du wissen wolltest, was das "n" bedeutet:
"n" steht immer für eine unverzweigte (normale) Kohlenwasserstoffkette, also beispielsweise wie bei n-Butan.
Viel Erfolg :)