Hi, hier chemweazle,
Gleichgewichtsreaktion und deren Einfluss anhand eines Versuches?
[Cu (H2O)4]2+ (aq) (blau) + 4 Cl- (aq) ⇌ [Cu(Cl)4]2- (aq) (grün) + 4 (H2O) (l)
Das MWG wäre ja:
Kc= c ([Cu(Cl)4]2-) * c4 (H2O)
-------‐-----------------------------------
c ([Cu (H2O)4]2+) * c4 (Cl-)
Die Reaktionsgleichung und MWG-Konstante für die Chloro-Komplexbildung sind schon gut und auch richtig formuliert.
Den Aqua-Kupfer(II)-Komplex kann man auch mit 6 Wasserliganden formulieren. 2 Liganden sind jedoch im größeren Abstand in trans-Stellung an das Kupferion gebunden. 4 Wassermoleküle sind dagegen in kürzren Abständen quadratisch planar um das Kupfer(II)-Ion koordiniert. Wenn man nur die Wasserliganden im kurzen Abstand betrachtet hat man den Tetra-aqua-Kupfer(II)-Komplex oder unter Berücksichtigung der 2 weiteren im größeren bindungsabstand gebundenen Liganden das Hexa-aqua-Kupfer(II)-Ion.
[Cu(H2O)6]2+ anstelle von [Cu(H2O)4]2+
Skizze
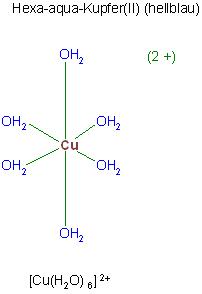
Hexa-aqua-Kupfer(II) (hellblau)
[Cu(H2O)6]2+(hellblau) + 4 Cl-(aq) ⇌ [Cu(Cl)4]2-(aq) + 6 H2O
MWG-Komplexbildungskonstante Kb([Cu(Cl)4]2-)
$$K_{b}([Cu(Cl)_{4}]^{2-}) = \dfrac{[Cu(Cl)_{4}]^{2-}\cdot [H_{2}O]^{6}}{[Cu(H_{2}O)_{6}]^{2+}\cdot [Cl^{-}]^{4}}$$
Zu
Wir haben hier einen Versuch durchgeführt:
Reaktionstyp: Ligandenaustauschreaktion, Ligandensubstitutionsreaktion
Hinreaktion: Ersatz der 6 Wasserliganden am hellblauen Hexa-aqua-Kupfer(II) durch 4 Chloridionen, die dann als quadratisch koordinierte Chloro-Liganden am Kupferion gebunden sind.
Hellblaues Hexa-aqua-Kupfer(II) wird zu grünen Terachlorocuprat(II)
Skizze
![[Cu(Cl)4]2-.JPG](https://www.chemielounge.de/?qa=blob&qa_blobid=6762505212538797796)
Rückreaktion
Ersatz der 4 Chloro-Liganden durch 6 Wasserliganden
Versuch
Vier Reagenzgläser werden mit Wasser und Kupfer(II)chlorid (CuCl2) aufgefüllt und folgendes hineingegeben und mit einem Bunsenbrenner erhitzt:
1. Zusätzlich Wasser (Blau-Färbung geblieben, nach einiger Zeit langsames Sprudeln (Gasentwicklung) zu sehen und allmählich eine Grün-Färbung)
Durch die Wasserzugabe wird das Gleichgewicht nach links in Richtung Hexa-aqua-Kupfer(II) verschoben.
2. Kochsalz (NaCl) (tiefgrüne Färbung, Sprudeln (stark), fast übergeschwappt)
Gleichgewicht nach rechts verschoben, durch die Zugabe von Chloridionen in Richtung TetraChlorocuprat(II)(grün)
3. CuCl2 "an sich (keine weitere Zugabe)" (zunächst leichte Gelb-Verfärbung, sprudeln und ebenfalls grüne Färbung)
Vielleicht ein Gemisch aus dem hellblauen Hexa-aqua-Kupfer(II)-Komplex und dem grünen Terachlorocuprat(II) durch Ligandenvertauschung(Dismutierung) ein Kupferchlorid gibt unter Aufnahme von 6 Wassermolekülen 2 Chloridionen an das nächste CuCl2-Teilchen, welches dann zum Tetrachloro-Komplex wird.
2 Cu(Cl)2 + 6 H2O ⇌ [Cu(H2O)6]2+(hellblau) + [Cu(Cl)4]2-(grün)
Also es stellt sich ei Gleichgewicht zwischen dem hellblauen Hexa-aqua-Kupfer(II)-Ionen und den grünen Tetrachlorocuprat(II)-Ionen ein.
Die Mischfarbe ist dann eher bräunlich bis grün.
4. Mehr Kupfer(II)chlorid, tieferes grün und heftigere Reaktion
und abschließend
5. Salzsäure, die war leider leer: weiß denn jemand was passiert?
Genau wie bei der Zugabe von NaCl, wird hier das Gleichgewicht durch die Erhöhung der Chloridionenkonzentration nach rechts verschoben. (Grünfärbung)
ZU
Sie hat was mit den unterschiedlichen Lagen der Komplexteilchen erklärt (Was sind Komplexteilchen und was haben sie hiermit zutun?) und erklärt, dass die Hinreaktion begünstigt wird, doch wieso?
Komplexteilchen sind die Komplexe, und mit den unterschiedlichen Lagen sind wohl die jeweils verschobenen Gleichgewichtslagen, verursacht durch Wasserzugabe oder Chlorid-Zugabe in Form von NaCl und HCl, gemeint.
ZU
Danach haben wir verdünnte blaue CuCl2 Lösung in ein Reagenzglas gegeben, erhitzt und mit einem Wasserstrahl abgekühlt - das habe ich auch nicht ganz verstanden :/
Das verstehe ich nun auch nicht.
Grüße chemweazle