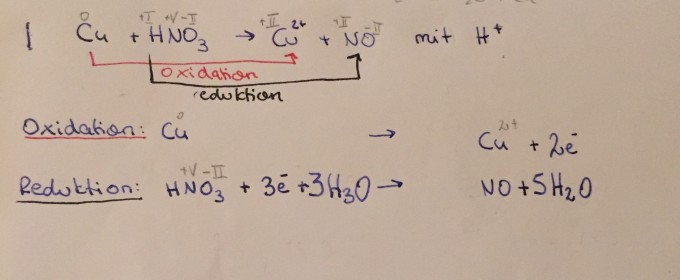
Hallo! Bin gerade dabei eine Redoxreaktion aufzustellen und komm nicht weiter...
mein Beispiel: siehe Anhang/ Foto
Ich muss jetzt die Elektronenbilanz ausgleichen. Weil ich nicht weitergekommen bin, habe ich gegoogelt und herausgefunden, dass ich bei der Oxidation mal 3 rechnen muss, bei der Reduktion mal 2. Nun meine Frage: Warum muss ich (genau) mit diesen Zahlen malnehmen?
Vielleicht kann mir das ja jemand verständlich erklären:)