Hi, here chemweazle,
Maße für die Reaktionsgeschwindigkeit auch Rate (englisch rate) genannt v(t)
Bei Gasreaktionen, wo das Volumen des Reaktionsgemisches sich ändert, verwendet man oft nur die Stoffmengenänderung nach der Zeit eines Reaktanden
$$ v(t) = \frac{dn}{dt}$$
Empfohlen wird auch, diese Änderung nach der Zeit durch den stöchiometrischen Koeffizienten zu teilen.
Zusätzlich gibt es noch die Empfehlung bei Ausgangsstoffen (Edukte) noch ein Minuszeichen davor zu setzen, im Sinne einer Abnahme der Stoffmenge oder den Stöchiometrischen Teil davon.
Beispiel die Bouduard- Reaktion
CO2(s) ⇔ 2 CO(g)
$$v(t) = - \frac{dn(CO_{2})}{dt} = + \frac{1}{2}\cdot \frac{dn(CO)}{dt}$$
Bei Reaktionen in Lösung und bei der Gewährleistung der Volumenkonstanz, d.h. bei einer Erwärmung der Reaktionsmischung wird entsprechend gekühlt, um eine rasche Wärmeableitung zu erreichen, damit die Ausdehnung des Volumens der Mischung nicht stattfindet.
Dann verwendet man als Reaktionsgeschwindigkeitsmaß die Reaktionsvariable.
Das ist meist die Konzentrationsänderung nach der Zeit.
$$v(t) = \frac{dc}{dt} = \frac{dc}{dt} = \frac{1}{V}\cdot \frac{dn}{dt}$$
Auch hier gibt es die Empfehlung die Konzentrationsänderung nach der Zeit durch den stöchiometrischen Koeffizienten zu teilen.
Beispiel 1
2 A + 5 B ⇔ 2 C + 10 D
$$v(t) = -\frac{1}{2}\cdot \frac{dc(A)}{dt} = -\frac{1}{5}\cdot \frac{dc(B)}{dt} = \frac{1}{2}\cdot \frac{dc(C)}{dt} = \frac{1}{10}\cdot \frac{dc(D)}{dt}$$
Beispiel 2
6H(+) + 2 MnO4(-) + 5 (COOH)2 ⇒ 2 Mn(2+) + 8 H2O + 10 CO2
$$v(t) = -\frac{1}{2}\cdot \frac{dc(MnO4^{(-)})}{dt} = -\frac{1}{5}\cdot \frac{dc((COOH)_{2})}{dt} = \frac{1}{2}\cdot \frac{dc(Mn^{(2+) )}}{dt}$$
Für vierlerlei Auswertungen reicht auch einfach die Konzentrationsänderung nach der Zeit als Reaktionsgeschwindigkeitsmaß aus. v(t) = dc/dt
Die Division durch den jeweiligen stöchiometrischen Koeffizienten ergibt sich während man mit den Konzentrationsänderungen nach der Zeit weiterrechnet.
a) Erstellen Sie die Reaktionsgleichung! Welcher Reaktionstyp liegt hier vor?
Reaktionstyp: Redoxreaktion
Das Oxidationsmittel Permanganat wird in stark saurer Lösung zum Mangan(II)sulfat reduziert.
Das Reduktionsmittel Oxalsäure wird zu Kohlendioxid oxidiert.
Aufstellung der Reaktionsgleichung
Aufstellung der Teilreaktion Reduktion des Permanganates
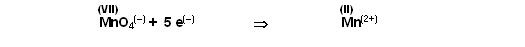
Schritt 1
Das Permanganat mit der Oxidationsstufe +7 wird zu Mangan(II) reduziert.
Es stimmen noch die Sauerstoff-bilanz nicht und die Wasserstoffbilanz sowie die Ladungsbilanz stimmen auf beiden Seiten der Reaktionsgleichung nicht.
Schritt 2
Die Sauerstoffbilanz wird für die saure Lösungen wie folgt ausgeglichen:
MO + 2 H(+) → M(2+) + H2O
MO bedeutet an ein Metall gebundenes Sauerstoffatom
links sind 4 Sauerstöffer am Mangan vom Permanganation, also fügen wir 4 H2O auf die rechte Seite zu.
So, nun sind links und rechts jeweils 4 Sauerstöffer.
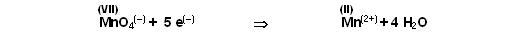
Schritt 3
Nun stimmt die Wasserstoffbilanz noch nicht.
Rechts sind 4 H2O, das macht 8 Wasserstöffer, rechts fügen wir dann 8 H(+)-Ionen zu.
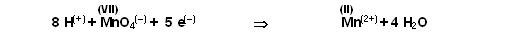
Jetzt stimmen die Manganbilanz, die Sauerstoffbilanz, die Wasserstoffbilanz auf beiden Seiten der Reaktionsgleichung.
Schritt 4
Nun schauen wir nach den Ladungen.
Rechte Seite: 8 positive Ladungen, eine negative v. Permanganation plus 5 negative Ladungen, also in summa: 8 -1-5= 2 positive Ladungen
Linke Seite: 2 positive Ladungen
Also die Teilgleichung für die Redukrtion des Permanganat stimmt.
Aufstellung und Ausgleich der 2ten Teilgleichung, die Oxidation der Oxalsäure
Oxalsäure: HO-(O=C)-(C=O)-OH
Die Oxidationsstufe des Kohlenstoffs beträgt in der Oxalsäure plus 3.
Diese wird zu Kohlendioxid oxidiert, in dem der Kohlenstoff die Oxidationsstufe plus 4 hat.
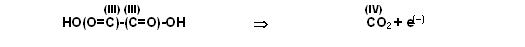
Schritt 1
Linke Seite 2 Kohlenstöffer in der Ox.-Stufe (III), rechts nur 1 Kohlendioxid Ox.-Stufe (IV).
Also auf der rechten Seite Faktor 2 vor dem Kohlendioxid und Faktor 2 vor den Elektronen.
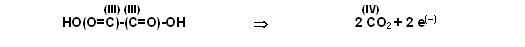
Jetzt stimmen die Kohlenstoffbilanz( 2links, 2rechts) und sogar die Sauerstoffbilanz (4 Sauerstöffer links, 4 Sauerstöffer rechts) auf beiden Seiten.
Schritt 2
Die Ladungsbilanz stimmt noch nicht auf beiden Seiten überein und die Wasserstoffbilanz stimmt auch noch nicht.
Linke Seite hat 2 Wasserstoffe mehr und die Gesamtladung links ist neutral, rechts dagegen fehlen 2 Wasserstöffer und zwei negative Ladungen mehr als rechts.
Also werden auf der rechten Seite noch 2 H(+)-Ionen zugefügt.
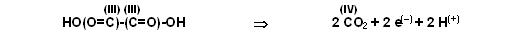
Nun stimmen alle Elementbilanzen und die Ladungsbilanz der Teilgleichung 2.
1 mol Permanganat nimmt in stark saurer Lösung 5 mol Elektronen auf. 1mol Oxalsäure gibt 2 mol Elektronen ab.
Also die Teilgleichung 2 mal 5 multiplizieren und die Teilgleichung 1 mit 2 multiplizieren.
Das Gemeinsame Vielfache von10 Elektronen, die vom Ox.-Mittel Permanganat aufgenommen und vom Reduktionsmittel abgegeben werden.
Dann wird die Summengleichung aus den beiden mit den Faktoren multiplizierten Teilgleichungen gebildet.

Summengleichung
16H(+) + 2 MnO4(-) + 10 + e(-) + 5 (COOH)2 ⇒ 2 Mn(2+) + 8 H2O + 10 CO2 + 10 e(-) + 10 H(+)
6H(+) + 2 MnO4(-) + 5 (COOH)2 ⇒ 2 Mn(2+) + 8 H2O + 10 CO2
c) In einem weiteren Versuchsansatz gibt man zeitnah zum Gemisch aus Oxalsäure- und Kaliumpermanganat-Lösung noch Mangan(II)-sulfat-Lösung hinzu. Es lässt sich eine raschere Entfärbung sowie Kohlenstoffdioxid-Entstehung beobachten als im vorherigen Versuchsansatz. Erklären Sie diese Beobachtung!
Stichwort: Autokatalyse
Wenn bei einer Reaktion ein Produkt entsteht, welches die Reaktion beschleunigt, also die Reaktionsgeschwindigkeit steigert(katalysiert), so spricht man von Autokatalyse.
Das Mangan(II) ist ein Reaktionsprodukt und katalysiert die Redoxreaktion, ja seine Entstehungs- oder Bildungsreaktion.
Untersuchungen führten zur Erkenntnis, das sich während der Reaktion gebildete Mangan(II)-Ionen mit Permanganat zu zu Mangan(III)-Verbindungen reagieren. Das Permanganat hat zwar eine höhere Oxidationsstufe, es reagiert aber langsamer.
Die Mangan(III)-Verbindung reagiert aber schneller unter Aufnahme eines Elektrons zum Mangan(II).
Entsteht im Verlauf der Reduktion des Permanganats mit Oxalsäure Mangan(II)-sulfat, so erfolgt eine Komproportionierung des Mangan(VII) mit der Mangan(II)-Verb. zu Mangan(III).
Vermute es ist das Hexaaquamangan(III)-Ion: [Mn(OH2)6]( 3+ )
Komproportionierung von Mn(VII) mit Mn(II) zu Mn(III)
MnO4(-) + 4 e (-) + 8 H(+) → Mn(3+) + 4 H2O
4 Mn(2+) → Mn(3+) + 4 e (-)
_________________________________________________________________________
8 H(+) + MnO4(-) + 4 Mn(2+) → 5 Mn(3+) + 4 H2O