Hi, hier chemweazle,
Zu
Leite aus dem Aufbau-Prinzip die Oktettregel her
Video-Empfehlung hierzu : musstewissen Chemie Oktett-Regel nach Lewis
Die Aufgabenstellung mit dem Wort herleiten irritiert mich auch schon sehr für längere Zeit.
Ersetzt man jedoch das Wort herleiten durch das Wort abzählen, dann käme ich mit dieser Aufgabenstellung vielleicht gedanklich zurecht.
Edelgase(noble gases) gehen keine Verbindungen ein. Das gilt eigentlich streng genommen für die ersten drei Vertreter: Helium, Neon und Argon. Vom Krypton kennt man seit Jahrzehnten das Difluorid KrF2 und vom Xenon seit dem Jahr 1962 eine Reihe von Fluor- und Sauerstoffverbindungen.
Die Ionisationsenergien sind im Vergleich zu anderen Elementen in der gleiche Zeile im Periodensystem am höchsten. Das heißt die Elektronen sitzen besoders fest in den Schalen, haben also eine relativ geringere potentielle Energie und somit eine geringere Elektronische Gesamtenergie. Die Gesamtenergie ist die Summe aus Kinetischer und Potentieller Energie der Elektronen.
Das Helium hat ein Elektronenduett, die K-Schale ist mit 2 Elektronen besetzt. Bei den höheren Homologen ist in der äussersten Schale ein Elektronenoktett, bestehend aus 2 s-Elektronen und 6 p-Elektronen in den Unterschalen.
Die Elektronenverteilung, auch Elektronenkonfiguration genannt, ist somit energiearm. Deshalb versuchen viele Elemente bei chem. Reaktionen mit Reaktionspartnern auch diese Elektronenkonfiguration (Oktett), beim Wasserstoff ist es das Duett, zu erreichen.
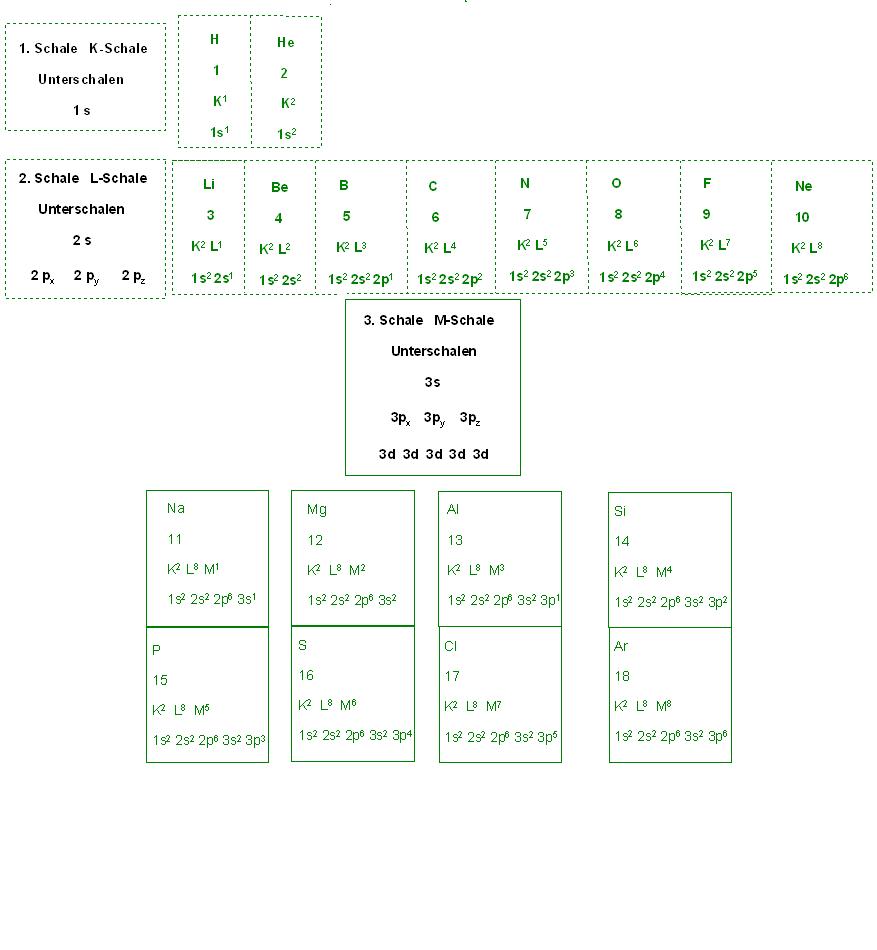
Auflistung der Elektronenkonfigurationen einiger Edelgase:
- Helium mit 2 Elektronen: [He] K2
- Neon mit 10 Elektronen: [Ne] K2 L8 mit Berücksichtigung der Unterschalen: 1s2 2s2 2p6
- Argon: mit 18 Elektronen: [Ar] K2 L8 M8 mit Berücksichtigung der Unterschalen: 1s2 2s2 2p6 3s2 3p6
- Krypton: mit 36 Elektronen: [Kr]K2 L8 M18 N8 mit Berücksichtigung der Unterschalen: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
Zur Anschauung und zum Nachzählen; Herleiten, der Duett-Oktett-Regel vom Meister Lewis sind Beispiele von chem. Reaktionen bei denen Ionenkristalle, also Salzartige Verbindungen, entstehen, aufgelistet. Man kann sehen, dass das Kation durch Abgabe der Valenzelektronen die Elektronenkonfiguration des vorrangegangenen Edelgases, das was im Periodensystem eine Zeile oberhalb steht, annimmt. Das entstandene Anion erreichte durch Aufnahme von Elektronen die Auffüllung der äussersten Schale zum Oktett, das ist die Elektronenkonfiguration des nachfolgenden Edelgases, welches in der gleiche Periode(Zeile) des Periodensystems steht.
Skizze: Ausschnitt aus dem Periodensystem bis einschließlich 3. Periode(Zeile)
Beispiele:
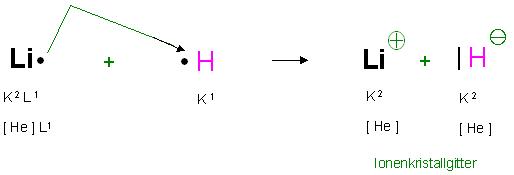
Bildung von Lithiumhydrid, LiH als Ionenkristall angenommen
In der Flamme oder einem heißem Gas reagieren Lithiumatome mit Wasserstoffatomen in einer Redoxreaktion.
Die Alkalielementatome(Lithiumatome) haben die Elektronenkonfiguration: K2 L1 oder mit Berücksichtigung der Unterschalen 1s2 2s1
oder einfacher gesagt ein Elektron mehr als das Helium [He] 2s1
Das Oxidationsmittel Wasserstoff, was das Elektron vom Lithiumatom entreißt hat die Konfiguration K1 oder 1s1, also ein Elektron weniger, als das nachfolgende Edelgas Helium.
Beim Lithiumhydrid besitzt das Lthiumkation die gleiche Edelgaskonfiguration wie das vorangegangene Edelgas Helium, nähmlich Li(+): K2, also [He], das Elektronen-Duett
Das Hydridion (Anion), H(-): K2 oder 1s2, also [He], das Elektronen-Duett
Skizze LiH
Bildung von Lithiumfluorid LiF
Das Fluoratom, das Halogenatom(Halogen : Salzbildner), hat die E-Kofiguration K2 L7, also ein Elektron weniger, als das Argon, das nachfolgende Edelgas in der gleichen Zeile(Periode) im Periodensystem.
Das Fluoridion(Halogenidion), das Anion, hat jetzt die Edelgaskonfiguration: K2 L8, also [Ar]
Skizze LiF
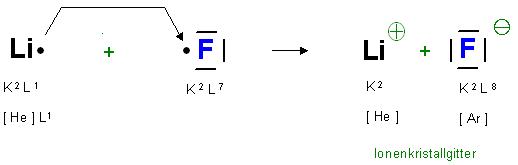
Bildung von MgO
Das Erdalkalimetall Magnesium hat 2 Elektronen mehr (Gesamtzahl 12 Elektronen), als das Edelgas Neon (Gesamtzahl 10 Elektronen).
Mg0: K2 L8 M2, [Ne] M2
Ne: K2 L8 , [Ne]
Das Magnesiumkation, Mg(2+) hat die gleiche Elektronenkonfiguration wie das Neon, und somit ein Oktett in der Außenschale.
Das Oxidationsmittel, das Chalkogen(Erzbildner) Sauerstoffatom hat insgesamt 8 Elektronen, also 2 Elektronen weniger, als Neon.
O-Atom: K2 L6
Das Oxidion, O(2-),das Anion im Magnesiumoxid hat die Neonkonfiguration K2 L8, also [Ne].
Skizze MgO
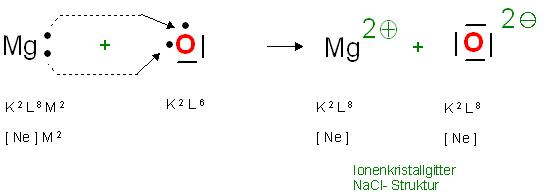
Bildung von NaCl
Das Alkalimetallatom Natrium hat elf Elektronen, ein Elektron mehr, als das Neon.
Na0: K2 L8 M1, also [Ne] M1
Das Natriumkation, Na(+) hat die Neonkonfiguration von 10 Elektronen, Oktett in der Außenschale, [Ne], K2 L8
Na(+): K2 L8, [Ne]
Das Chloratom, Halogenatom,die Gesamtelektronenzahl ist 17, hat mit sieben Ausseneletronen nur 1 Elektron weniger, als das Edelgas Argon mit 18 Elektronen.
Chloratom: K2 L8 M7
Chloridion, Cl(-); 18 Elektronen, wie Argon, [Ar]-Konfiguration, K2 L8M8
Skizze NaCl
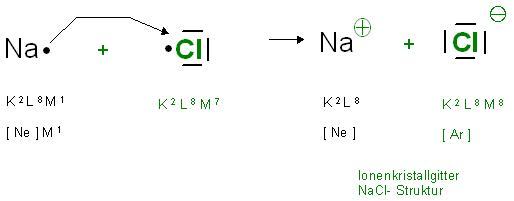
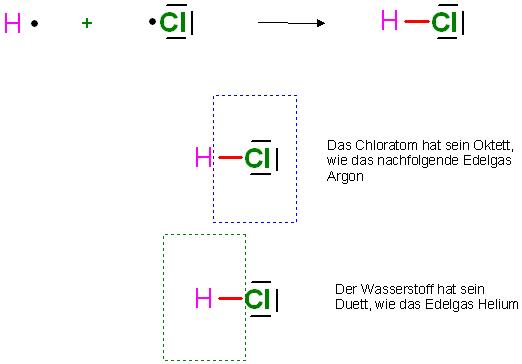
Beim Chlorwasserstoff H-Cl
Im Daniell´schen Hahn, das ist wie ein Schweißbrenner, wird Wasserstoff mit Chlor statt Sauerstoff zu Chlorwasserstoff verbrannt.
In der heißenFlamme reagieren Chloratome und Wasserstoffatome in einer Redoxreaktion miteinander zu Chlorwasserstoffgas.
Im H-Cl- Molekül hat das Chloratom sein Oktett und das Wasserstoffatom sein Duett erreicht.
Skizze HCl