Salut,
Wie kann man die Formalladung von COCl2 berechnen? Hilft mir die Formalladung auch dabei zu wissen ob ich bei der Lewisstruktur eine Doppelbindung brauche?
Betrachte zunächst die Gesamtzahl der Valenzelektronen:
COCl2: C = 4, O = 6, 2*Cl = 2*7, macht zusammen 24 Valenzelektronen.
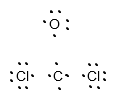
Die folgende Lewis - Struktur zeigt nun die Atome mit gepaarten Valenzelektronen:
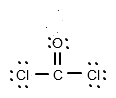
(Quelle: Eigene Grafik)
Cl - Atome teilen also Einfachbindungen mit C, das O - Atom hingegen bildet eine Doppelbindung mit C. Dadurch ist die Oktettregel erfüllt und jedes Atom hat 8 Valenzelektronen, was die molekulare Stabilität ermöglicht.
So, nun zähle die freien Elektronenpaare in der Lewis - Struktur und addiere sie mit den Bindungelektronen:
C = 0 freie Paare + 4 Bindungselektronen = 4 Elektronen
O = 4 Elektronen von freien Paaren + 2 Elektronen von Bindungen = 6 Elektronen.
Cl = 6 Elektronen freier Paare + 1 Elektron einer Bindung mit C = 7 Elektronen.
Die Formalladung für jedes Atom erhältst du schlussendlich, indem du die Valenzelektronen im ungebundenen Atom minus die in der Lewis - Struktur bezeichneten Elektronen berechnest:
C: 4 Valenzelektronen im ungebundenen Atom minus 4 in der Lewis - Struktur ergibt 0 Formalladung.
O: 6 Val.elektr. im ungebundenen Atom minus 6 in der LS ergibt 0 Formalladung.
Cl: 7 Val.elektr. im ungebundenen Atom minus 7 in der LS ergibt 0 Formalladung
Schöne Grüße :)