Hi, hier chemweazle,
Zu
10 g eines nickelhaltigen Minerals werden auf den Massenanteil von Nickel untersucht. Dafür wird das Nickel mit Dimethylglyoxim ausgefällt. Der Niederschlag wiegt 5 g. Gesucht ist der Massenanteil von Nickel im Mineral (Molmasse(Ni)=58,7 g/mol.
Gesucht ist w(Ni):
$$w(Ni) = \frac{m(Ni)}{m(Mineral)} = \frac{m(Ni)}{10\cdot g}$$
Reaktionsgleichung der Nickelfällung als Bis-glyoxymato-Nickel(II) mit Diacetyldioxim, dem Tschugaev-Reagenz
[Ni(H2O)6]2+ + 2 HO-N=C(CH3)-C(CH3)C=N-OH → [Ni(-O-N=C(CH3)-C(CH3)C=N-OH)2] + 6 H2O + 2 H+
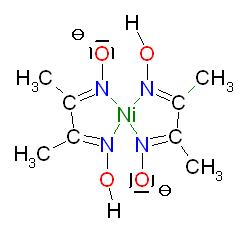
Struktur des Komplexes, bestehend aus einem Ni(II)-Kation und 2 -O-N=C(CH3)-C(CH3)C=N-OH- Anionen als Liganden, dieser Komplex ist nach aussen hin ungeladen
Skizze
Molmasse des roten kristallinen Feststoffes:
M(C8H14N4O4) = (12,011*8+1,0079*14+14,0067*4+15,9994*4) g / mol = 230,223 g / mol
Die Stoffmenge an Bis-glyoxymato-Nickel(II) der 5g Masse des Niederschlages der Fällung sei mit n(Ni(Glyox)2) abgekürzt.
Die Masse des Niederschlages, (5 g), sei mit m(Ni(Glyox)2) und die Molmasse sei mit M((Ni(Glyox)2) abgekürzt.
m(Ni(Glyox)2) = 5 g
M(Ni(Glyox)2) = 230,223 g / mol
n(Ni(Glyox)2) = m(Ni(Glyox)2) / M((Ni(Glyox)2):
$$n(Ni(Glyox)_{2}) = \frac{m(Ni(Glyox)_{2})}{M(Ni(Glyox)_{2})}$$
$$n(Ni(Glyox)_{2}) = \frac{5\cdot g\cdot mol}{230,223\cdot g} = 0,0217\cdot mol$$
Die Masse an Nickel in der Mineralprobe ist die Stoffmenge an Bis-glyoxymato-Nickel(II), (n(Ni(Glyox)2)), multipliziert mit der Molmasse von Nickel, M(Ni).
m(Ni) = n(Ni(Glyox)2) * M(Ni) = 0,0217 mol * 58,7 g / mol = 1,27379 g ≈ 1,274 g
$$w(Ni) = \frac{m(Ni)}{m(Mineral)} = \frac{1,274\cdot g}{10\cdot g}$$
w(Ni) = 0,1274 = 12,74 %